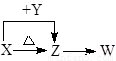题目内容
化合物A由短周期元素X、Y组成,是良好的耐热冲击材料.已知:(1)元素X、Y不同周期 (2)X的单质既可与盐酸反应,又可与NaOH溶液反应. (3)一定条件下,A和水缓慢作用生成含Y的气体化合物Z,Z分子含有四个原子核10个电子.Z与H2O2反应,其产物之一是Y的单质.则
①Z与H2O2反应的化学方程式 ;
②X与NaOH溶液反应的离子方程式为 ;
③A的化学式是 .
【答案】分析:X的单质既可与盐酸反应,又可与NaOH溶液反应,则X为Al,元素X、Y不同周期,都属于短周期元素,则Y在第二周期,再由一定条件下,A和水缓慢作用生成含Y的气体化合物Z,Z分子含有四个原子核10个电子,则Y为N,Z为NH3,然后依据物质的性质来解答.
解答:解:由X的单质既可与盐酸反应,又可与NaOH溶液反应,则X为Al,元素X、Y不同周期,都属于短周期元素,则Y在第二周期,再由一定条件下,A和水缓慢作用生成含Y的气体化合物Z,Z分子含有四个原子核10个电子,则Y为N,Z为NH3,
①X为Al,Y为N,则Z为NH3,Z与H2O2反应,其产物之一是Y的单质,由氧化还原反应可知,NH3与H2O2反应生成N2和H2O,该反应为2NH3+3H2O2═N2+6H2O,
故答案为:2NH3+3H2O2═N2+6H2O;
②Al与NaOH溶液反应生成偏铝酸钠和氢气,离子反应为2Al+2H2O+2OH-═2AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-═2AlO2-+3H2↑;
③X为Al,Y为N,A由短周期元素X、Y组成,则A为AlN,故答案为:AlN.
点评:本题考查位置、结构、性质关系的应用,熟悉Al的性质、氧化还原反应、10电子微粒是解答本题的关键,难度不大,N元素的推断是解答本题的难点和易错点.
解答:解:由X的单质既可与盐酸反应,又可与NaOH溶液反应,则X为Al,元素X、Y不同周期,都属于短周期元素,则Y在第二周期,再由一定条件下,A和水缓慢作用生成含Y的气体化合物Z,Z分子含有四个原子核10个电子,则Y为N,Z为NH3,
①X为Al,Y为N,则Z为NH3,Z与H2O2反应,其产物之一是Y的单质,由氧化还原反应可知,NH3与H2O2反应生成N2和H2O,该反应为2NH3+3H2O2═N2+6H2O,
故答案为:2NH3+3H2O2═N2+6H2O;
②Al与NaOH溶液反应生成偏铝酸钠和氢气,离子反应为2Al+2H2O+2OH-═2AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-═2AlO2-+3H2↑;
③X为Al,Y为N,A由短周期元素X、Y组成,则A为AlN,故答案为:AlN.
点评:本题考查位置、结构、性质关系的应用,熟悉Al的性质、氧化还原反应、10电子微粒是解答本题的关键,难度不大,N元素的推断是解答本题的难点和易错点.

练习册系列答案
相关题目
(14分)X、Y、Z三种化合物均由短周期元素组成。已知三种化合物的水溶液的焰色反应均呈黄色,Y和Z均由三种元素组成。请根据题目的要求回答下列问题。
(1)固体化合物X为浅黄色粉末,该化合物中含有化学键为 (填序号)。
A.离子键 B.极性共价键 C.非极性共价键
(2)写出X与二氧化碳反应的化学方程式 。
(3)下表为Y和Z实验的部分内容
| 序号 | 主要实验步骤及实验现象 |
| ① | 在Y的无色溶液中,加入稀硫酸,放置。产生浅黄色沉淀和无色有刺激性气味的气体。该气体可使品红溶液褪色。 |
| ② | 在Z的无色溶液中,滴加的盐酸,开始有白色沉淀,继续滴加盐酸,白色沉淀先增加后消失,然后加入过量的氨水又出现白色沉淀。 |
| ③ | 将实验②最终得到的混合物加热蒸发、灼烧,最终得到固体。 |
写出含0.1 mol Z的溶液与20 mL 5mol/L的盐酸反应的离子方程式:
实验③加热蒸发、灼烧得到的最终产物主要是 和 。
(4)写出Y与稀硫酸反应的离子方程式 。