题目内容
已知
①2C(s)+O2(g)===2CO(g);ΔH=-221.0kJ·mol-1
②2H2(g)+O2(g)===2H2O(g);ΔH=-483.6kJ·mol-1
则反应C(s)+H2O(g)===CO(g)+H2(g)的ΔH为
| A.+131.3kJ·mol-1 | B.-131.3kJ·mol-1 |
| C.-352.3kJ·mol-1 | D.+262.6kJ·mol-1 |
A
解析试题分析:根据盖斯定律知反应(①-②)/2得目标反应,则ΔH=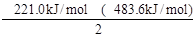 = 131.3kJ/mol。答案选A。
= 131.3kJ/mol。答案选A。
考点:盖斯定律
点评:不管化学反应是一步完成或分几步完成,其反应热是不变的。即化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。

练习册系列答案
相关题目