题目内容
在500 mL CuSO4和Fe2(SO4)3的混合溶液中加入21.7 g铁粉,待反应完全后,得到16.8 g残留固体。在滤液中加入400 mL 4 mol·L-1的BaCl2溶液,恰好使溶液中的 完全沉淀。求原混合物中CuSO4和Fe2(SO4)3的物质的量浓度。
完全沉淀。求原混合物中CuSO4和Fe2(SO4)3的物质的量浓度。
 完全沉淀。求原混合物中CuSO4和Fe2(SO4)3的物质的量浓度。
完全沉淀。求原混合物中CuSO4和Fe2(SO4)3的物质的量浓度。c〔Fe2(SO4)3〕="0.25" mol·L-1,c(CuSO4)="2.45" mol·L-1
根椐题意,Fe3+全部参加反应,Cu2+可能全部参加反应,也可能有剩余。若列方程求解,两种情况都成立,但实际上前一种情况不可能,这给解题造成了错误。用极值法求解,就可避免错误的发生。
n( )=n(Ba2+)="4" mol·L-1× 0.4 L="1.6" mol
)=n(Ba2+)="4" mol·L-1× 0.4 L="1.6" mol
若原溶液溶质全部是CuSO4,则需铁1.6 mol×56 g·mol-1="89.6" g
若原溶液溶质全部是Fe2(SO4)3,则需铁(1.6 mol/3)×56 g·mol-1="29.9" g
因而实际需铁应介于29.9—89.6 g之间。
现加入的铁只有21.7 g,所以残留的16.8 g固体全部是Cu。
加入21.7 g铁,所以残留的固体全为铜。
生成的铜的物质的量:n(Cu)=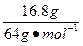 ="0.262" 5 mol
="0.262" 5 mol
加入的铁的物质的量:n(Fe)=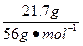 ="0.387" 5 mol
="0.387" 5 mol
因Fe3+的氧化性大于Cu2+,铁粉先与Fe2(SO4)3反应,剩余的Fe再与CuSO4反应,与Fe2(SO4)3反应的铁为0.387 5 mol-0.262 5 mol="0.125" mol
c〔Fe2(SO4)3〕= ="0.25" mol·L-1〔1 mol Fe与1 mol Fe2(SO4)3反应〕
="0.25" mol·L-1〔1 mol Fe与1 mol Fe2(SO4)3反应〕
n(CuSO4)="1.6" mol-3n〔Fe2(SO4)3〕="1.6" mol-3×0.125 mol="1.225" mol
c(CuSO4)=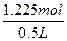 ="2.45" mol·L-1。
="2.45" mol·L-1。
n(
 )=n(Ba2+)="4" mol·L-1× 0.4 L="1.6" mol
)=n(Ba2+)="4" mol·L-1× 0.4 L="1.6" mol 若原溶液溶质全部是CuSO4,则需铁1.6 mol×56 g·mol-1="89.6" g
若原溶液溶质全部是Fe2(SO4)3,则需铁(1.6 mol/3)×56 g·mol-1="29.9" g
因而实际需铁应介于29.9—89.6 g之间。
现加入的铁只有21.7 g,所以残留的16.8 g固体全部是Cu。
加入21.7 g铁,所以残留的固体全为铜。
生成的铜的物质的量:n(Cu)=
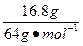 ="0.262" 5 mol
="0.262" 5 mol加入的铁的物质的量:n(Fe)=
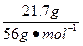 ="0.387" 5 mol
="0.387" 5 mol因Fe3+的氧化性大于Cu2+,铁粉先与Fe2(SO4)3反应,剩余的Fe再与CuSO4反应,与Fe2(SO4)3反应的铁为0.387 5 mol-0.262 5 mol="0.125" mol
c〔Fe2(SO4)3〕=
 ="0.25" mol·L-1〔1 mol Fe与1 mol Fe2(SO4)3反应〕
="0.25" mol·L-1〔1 mol Fe与1 mol Fe2(SO4)3反应〕n(CuSO4)="1.6" mol-3n〔Fe2(SO4)3〕="1.6" mol-3×0.125 mol="1.225" mol
c(CuSO4)=
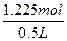 ="2.45" mol·L-1。
="2.45" mol·L-1。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 N2+6NH3+3SO2+SO3+7H2O的反应中,当有NA个电子发生转移时,以下说法错误的是( )
N2+6NH3+3SO2+SO3+7H2O的反应中,当有NA个电子发生转移时,以下说法错误的是( ) NA个硫原子被还原
NA个硫原子被还原 NA个氮原子被氧化
NA个氮原子被氧化 NA个二氧化硫分子生成
NA个二氧化硫分子生成 NA个硫酸铵分解
NA个硫酸铵分解