题目内容
已知NH4+与HCHO在水溶液中有如下反应:4NH4++6HCHO→(CH2)6N4+6H2O+4H+
现有一失去标签的铵盐,为了测定其含氮量,称取2 g样品溶于水,加入足量HCHO溶液配成100 mL溶液,再取出10 mL,向其中逐滴加入0.1 mol·L-1NaOH溶液,当滴到25 mL时溶液呈中性,求该铵盐中氮的质量分数.
答案:35%
解析:
解析:
| 解析:根据题目提供的信息,有关粒子物质的量关系为N—NH4+—H+—OH-,参加反应的OH-物质的量为n(OH-)=0.1 mol·L-1×25×10-3L=0.0025 mol;2 g铵盐中NH4+的物质的量为n( 该铵盐可能是NH4NO3;②若酸根为-2价,其摩尔质量为2g/0.0125 mol=160g·mol-1无此铵盐;③同理酸根为-3价时亦无解,此铵盐只能是NH4NO3.氮的质量分数为35%.
|

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
|
已知NH4+与HCHO在水溶液中有如下反应:4NH4++6HCHO→(CH2)6N4+4H++6H2O.现有一失去标签的铵盐氮肥.为测定其含氮量,今称取2.00g样品溶于水,加入足量的HCHO溶液,共配得100mL溶液,从中取出10mL,滴入酚酞后,再逐滴加入0.100mol/LNaOH溶液,当滴至25.00mL时溶液呈现出了粉红色,且在半分钟内未褪色,该铵盐中氮的质量分数为 | |
| [ ] | |
A. |
0.175 |
B. |
0.177 |
C. |
0.350 |
D. |
无法计算 |
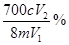 B.
B.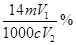 C.
C.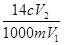 D.
D.