题目内容
(13分)
Ⅰ.(3分)下列实验操作中正确的是
A.分液时,分液漏斗下层液体从下端放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.蒸发结晶时应将溶液直接蒸干
D.称量非腐蚀性药品应放在托盘天平左盘的称量纸上,砝码放在托盘天平右盘的称量纸上
Ⅱ.(10分)影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究。他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素。甲同学的实验报告如下表:
|
实验步骤 |
现象 |
结论 |
|
①分别取等体积2mol/L的硫酸于试管中 ② |
反应速率Mg>Fe,Cu反应最慢 |
金属性质越活泼,反应 速率越快 |
(1)甲同学表中实验步骤②为 ;
(2) 甲同学的实验目的是 ;要得出正确的实验结论,还需要控制的实验条件是 。
乙同学为了更精确地研究浓度对反应速率的影响,利用右图所示装置进行定量实验。
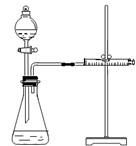
(3)乙同学在实验中应该测定的数据是 ;
(4)乙同学完成实验应选用的实验药品是 。
Ⅰ.(3分,选对1个得1分,见错不得分,全选不得分)ABD
Ⅱ.(10分,每空2分)
(1)分别投入形状、大小相同的Cu、Fe、Mg
(2)探究金属(反应物)本身的性质与反应速率的关系;温度相同
(3)测定一定时间内产生气体的体积(或产生一定体积的气体所需要的时间)
(4)Mg(或Fe)、0.2mol/L硫酸和2mol/L硫酸
【解析】Ⅰ.蒸发结晶时不应该将溶液直接蒸干,而是当有大量晶体析出时,即可停止加热,选项C不正确,其余都是正确的,答案选ABD。
Ⅱ.(1)要比较金属和稀硫酸的反应快慢,则应该使金属的形状和大小都是相同的,即分别投入形状、大小相同的Cu、Fe、Mg。
(2)根据属于步骤和现象控制,目的是探究金属(反应物)本身的性质与反应速率的关系;要比较反应速率,除了控制浓度相同外,温度还应该是相同的。
(3)要定量研究,则需要测定一定时间内产生气体的体积(或产生一定体积的气体所需要的时间)。
(4)浓硫酸和金属反应不能生成氢气,而铜与稀硫酸又不反应,所以选择的药品是Mg(或Fe)、0.2mol/L硫酸和2mol/L硫酸。

 名校课堂系列答案
名校课堂系列答案| A、分液时,碘的四氯化碳溶液从分液漏斗上口逐步倒出 | B、为检验Na2CO3溶液中是否混有少量NaOH,可先向溶液中滴加CaCl2溶液至过量,再滴加几滴酚酞试液观察溶液是否变红 | C、容量瓶检漏的操作是:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置,观察是否漏水 | D、蒸馏操作时,应使温度计水银球插入液体里,测定液体的温度 |
| A、制取溴苯:将铁屑、溴水、苯混合加热 | B、实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸 | C、鉴别甲苯和苯:向甲苯和苯中分别滴入酸性KMnO4溶液,振荡,观察是否褪色 | D、检验卤代烃中的卤原子:加入NaOH溶液共热,然后加入稀硝酸至溶液呈酸性,再加AgNO3溶液,观察沉淀的颜色 |