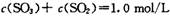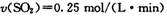题目内容
在恒温恒容条件下,向容积为2L的密闭容器中充入2.0molSO2和2.0molO2。已知:2SO2(g)+O2(g)2SO3(g) ∆H=-akJ/mol(a>0),经2min达到平衡状态,反应放热0.25akJ。下列判断正确的是
A、在1min时:c(SO3)+c(SO2)=1.0 mol·L-1
B、在2min内:v(SO2)=0.25 mol·L-1·min-1
C、若再充入2molSO3,达到平衡时SO3的质量分数减小
D、反应条件相同,若起始时向反应容器充入2molSO3,达到平衡时反应吸热0.75 akJ
A
解析:根据硫原子守恒可知A是正确的。根据方程式可知,当反应放热0.25akJ时,消耗的二氧化硫是0.5mol,生成三氧化硫也是0.5mol,剩余二氧化硫是1.5mol,其浓度是
![]() ,B不正确。若平衡时再充入2molSO3,则相当于增大压强,平衡向正反应方向移动,所以达到平衡时SO3的质量分数增大,C不正确。2molSO3相当于2.0molSO2和1.0molO2,因此和原状态比较二氧化硫的转化率要降低,平衡时三氧化硫的物质的量要小于0.5mol,所以达到平衡时反应吸热的能量要大于0.75 akJ,D不正确。答案选A。
,B不正确。若平衡时再充入2molSO3,则相当于增大压强,平衡向正反应方向移动,所以达到平衡时SO3的质量分数增大,C不正确。2molSO3相当于2.0molSO2和1.0molO2,因此和原状态比较二氧化硫的转化率要降低,平衡时三氧化硫的物质的量要小于0.5mol,所以达到平衡时反应吸热的能量要大于0.75 akJ,D不正确。答案选A。

练习册系列答案
相关题目
 2SO3(g) ∆H=-akJ/mol(a>0),经2min达到平衡状态,反应放热0.25akJ。下列判断正确的是
2SO3(g) ∆H=-akJ/mol(a>0),经2min达到平衡状态,反应放热0.25akJ。下列判断正确的是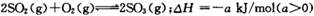 ,经2 min达到平衡状态,反应放热0. 25a kJ。下列判断正确的是
,经2 min达到平衡状态,反应放热0. 25a kJ。下列判断正确的是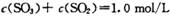

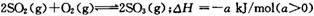 ,经2 min达到平衡状态,反应放热0. 25a kJ。下列判断正确的是
,经2 min达到平衡状态,反应放热0. 25a kJ。下列判断正确的是