题目内容
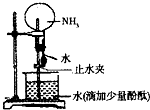
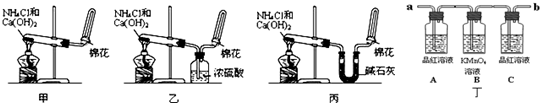
实验室常用消石灰和NH4Cl固体混合加热制取氨气,回答下列问题:
(1)写出该反应的化学方程式______.
(2)要得到纯净干燥的氨气,可选用的干燥剂是______.
A、浓硫酸B、碱石灰C、五氧化二磷D、固体NaOH
(3)检验氨气常用的方法是______.
(1)写出该反应的化学方程式______.
(2)要得到纯净干燥的氨气,可选用的干燥剂是______.
A、浓硫酸B、碱石灰C、五氧化二磷D、固体NaOH
(3)检验氨气常用的方法是______.
(1)实验室制备氨气是利用氯化铵和氢氧化钙加热反应生成,反应的化学方程式为Ca(OH)2+2NH4Cl
2NH3↑+2H2O+CaCl2,
故答案为:Ca(OH)2+2NH4Cl
2NH3↑+2H2O+CaCl2;
(2)氨气是碱性气体用碱性干燥剂干燥,不能用酸性干燥剂干燥;
A、浓硫酸是酸和氨气反应,不能用来干燥剂,故A不符合;
B、碱石灰是氢氧化钠和氧化钙固体碱性干燥剂,故B符合;
C、五氧化二磷吸收水反应生成磷酸,磷酸和氨气反应,故C不符合;
D、固体NaOH是碱,可以干燥氨气,故D符合;
故答案为:BD;
(3)检验氨气常用的方法是利用氨气能使湿润的红色石蕊试纸变蓝证明,
故答案为:用湿润的红色石蕊试纸检验,若变蓝证明是NH3.
| ||
故答案为:Ca(OH)2+2NH4Cl
| ||
(2)氨气是碱性气体用碱性干燥剂干燥,不能用酸性干燥剂干燥;
A、浓硫酸是酸和氨气反应,不能用来干燥剂,故A不符合;
B、碱石灰是氢氧化钠和氧化钙固体碱性干燥剂,故B符合;
C、五氧化二磷吸收水反应生成磷酸,磷酸和氨气反应,故C不符合;
D、固体NaOH是碱,可以干燥氨气,故D符合;
故答案为:BD;
(3)检验氨气常用的方法是利用氨气能使湿润的红色石蕊试纸变蓝证明,
故答案为:用湿润的红色石蕊试纸检验,若变蓝证明是NH3.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
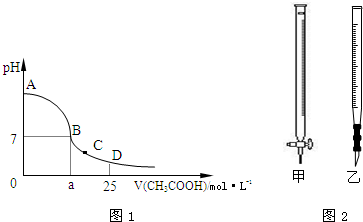
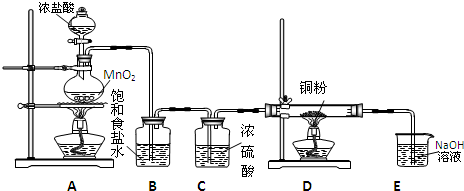
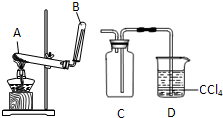
 Ca2++
Ca2++ KCl+2O2↑,请写出在400℃的化学反应方程式 (提示:反应中只有氯元素的化合价改变)。
KCl+2O2↑,请写出在400℃的化学反应方程式 (提示:反应中只有氯元素的化合价改变)。