��Ŀ����
��12�֣������ձ�Ӧ�õĹ�ҵ�ϳɰ��ķ����ǹ�����1905�귢���ģ����˷���Ӧ���ת���ʲ��ߡ�
��1����֪1 mol N2(g)������H2(g)��ȫ��Ӧ��������NH3(g)0.1molʱ���ų�9.22kJ������д����Ӧ���Ȼ�ѧ����ʽ�� ��
��2�����÷�Ӧ��298K��398Kʱ�Ļ�ѧƽ�ⳣ���ֱ�ΪK1��K2����K1 K2������� ��="��" �� ������ ����
��3����һ���¶��£����ݻ����䣨ʼ��Ϊ10L�����ܱ������м���2 mol N2��8 mol H2 �����������10���Ӻ�Ӧ�ﵽƽ��״̬������������ѹǿ��Ϊ��ʼ��80������ʱ�������������Ϊ ���õ�����ʾ�ķ�Ӧ���ʣ� ��������߰����IJ��ʣ����ݻ�ѧƽ���ƶ�ԭ��������������Ľ��飺 ������дһ������
��4����������ͬ�����£�����ʼʱ����4 mol NH3��2 mol H2�������������Ӧ�ﵽƽ��ʱNH3�����������(3)�� �������С������ȡ�����
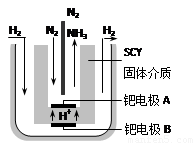
��5�����ŶԺϳɰ��о��ķ�չ��2001����λϣ����ѧ������˵��ϳɰ��ķ��������ڳ�ѹ�°��������ú���ϡ�͵ĵ������ֱ�ͨ��һ�����ȵ�570��ĵ����У����ø����ӵ����Ե�SCY�մɣ��ܴ���H+��Ϊ���ʣ�������������������ϵĽ����ٶྦྷ��Ĥ���缫��ʵ���˳�ѹ��570�������¸�ת���ʵĵ�ⷨ�ϳɰ���װ������ͼ�����ڵ�ⷨ�ϳɰ��ĵ����� (��ܡ����ܡ�) ��ˮ���������Һ���ܼ���ԭ���� ��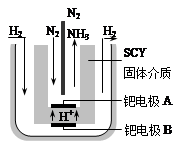
�ٵ缫A�ǵ��ص� ��������������������ü��ϵĵ缫��Ӧʽ�� ��
��1��N2(g)+3H2(g) 2NH3(g) ��H ��-184.4 kJ��mol-1 (2��)
2NH3(g) ��H ��-184.4 kJ��mol-1 (2��)
��2�� > (1��)
��3��25% (2��) ��0.01mol/(L��min) (1��)����������Ũ�Ȼ�������Ũ�Ȼ�����Ӧ��Ũ�Ȼ��»�����ѹǿ��ʱת�������ɵİ������������𰸾��÷֣�(1��)
��4����� (1��)
��5�����ܣ��·��ϳɰ����صķ�Ӧ�¶���570��ʱ��ˮΪˮ������
���� N2 + 6e��+6H+ ="=" 2NH3 ��4�֣���1�֣�
����


 2NH3���ǹ�����1905�귢���ģ����˷��ﵽƽ��ʱ��Ӧ���ת���ʲ��ߡ�
2NH3���ǹ�����1905�귢���ģ����˷��ﵽƽ��ʱ��Ӧ���ת���ʲ��ߡ� 2NH3�ķ�Ӧ������ͼ��ʾN2�����ʵ�����ʱ��ı仯���ߡ���H2��ʾ0~10min�ڸ÷�Ӧ��ƽ������v(H2)=_______________����11min��ѹ�����������Ϊ
2NH3�ķ�Ӧ������ͼ��ʾN2�����ʵ�����ʱ��ı仯���ߡ���H2��ʾ0~10min�ڸ÷�Ӧ��ƽ������v(H2)=_______________����11min��ѹ�����������Ϊ