��Ŀ����
ͭ������ϡ���ᷴӦ��Ҳ����Ũ���ᷴӦ����ͭ��һ��Ũ�����ᷴӦʱ���ɽ�����ʽ��ʾΪ��Cu+HNO3��Cu��NO3��2+NO��+NO2��+H2O ������ʽδ��ƽ��������2NO2? N2O4������1�������ڸ÷�Ӧ�е������� ��
��2��0.004molCu��������ȫ�ܽ��Cuʧȥ�ĵ������� ������õ���NO��NO2���ʵ�����ͬ����μӷ�Ӧ����������ʵ����� ���ڱ�״���������ռ�NO��NO2�ļ���ƿ������ˮ�У�ͨ��һ������������ַ�Ӧ����������ʣ�࣬��ͨ��O2�����Ϊ ��������Һ���������ʲ���ɢ�������ʵ���Ũ���� ��
��3������μӷ�Ӧ��Cu��HNO3�����ʵ���֮����3��10��д������ƽ�÷�Ӧ�����ӷ���ʽ ��
��4�����û�жԸ÷�Ӧ�е�ijЩ���ʵı�����������ʽ���ܵ���ƽϵ���������飮ԭ���� ��
���𰸡���������1����Ӧ�е�Ԫ�ػ��ϼ���+5�۽���Ϊ+2��+4�ۣ��������������ԣ�ͬʱ���������Σ������������ԣ�
��2��ͭʧȥ2�������γ�Cu2+��ʧȥ�ĵ������ʵ�����ͭ��2�����ݴ˼��㣮
���ݵ���ת���غ����NO��NO2�����ʵ���������ͭԪ���غ��������ͭ�����ʵ��������ݵ�Ԫ���غ��֪�μӷ�Ӧ����������ʵ���n��HNO3��=2n[Cu��NO3��2]+n��NO2��+n��NO����
���ݷ���ʽ4NO2+O2+2H2O=4HNO3��4NO+3O2+2H2O=4HNO3��������Ҫͨ��O2�����ʵ�����������������ʵ���������V=cVm���������������Һ�������һ��������������������֮�ͣ�����c=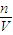 ��������Ũ�ȣ�
��������Ũ�ȣ�
��3����ͭΪ3mol����HNO3Ϊ10mol������ͭԪ���غ��֪����������ͭ3mol���������������õ�����Ϊ10mol-6mol=4mol��������NOΪxmol��������NO2Ϊ��4-x��mol�����õ���ת���غ��з��̼���xֵ���ݴ���д���ӷ���ʽ��
��4���÷�Ӧ��������������ԭ��Ӧ�����ߵı����������������������Է����仯��
����⣺��1����Ӧ�е�Ԫ�ػ��ϼ���+5�۽���Ϊ+2��+4�ۣ��������������ԣ�ͬʱ���������Σ������������ԣ�
�ʴ�Ϊ�������ԡ����ԣ�
��2��ͭʧȥ2�������γ�Cu2+��ʧȥ�ĵ������ʵ�����ͭ��2����0.004molCu��������ȫ�ܽ��
Cuʧȥ�ĵ�������0.004mol×2×NAmol-1=0.008NA��
����ͭԪ���غ㣬n[Cu��NO3��2]=n��Cu��=0.004mol����NO��NO2�����ʵ���Ϊymol��
���ݵ���ת���غ���3y+y=0.004×2�����y=0.002�����ݵ�Ԫ���غ��֪���μӷ�Ӧ����������ʵ���
n��HNO3��=2n[Cu��NO3��2]+n��NO2��+n��NO��=0.004mol×2+0.002mol+0.002mol=0.012mol��
���ݷ���ʽ4NO2+O2+2H2O=4HNO3��4NO+3O2+2H2O=4HNO3��֪����Ҫͨ��O2�����ʵ���Ϊ
0.002mol× +0.002mol×
+0.002mol× =0.002mol��������������ʵ���Ϊ0.002mol+0.002mol=0.004mol��������Ҫ���������Ϊ
=0.002mol��������������ʵ���Ϊ0.002mol+0.002mol=0.004mol��������Ҫ���������Ϊ
0.002mol×22.4L/mol=0.0448L=44.8ml����Һ�������һ��������������������֮�ͣ�������Һ�����Ϊ
0.004mol×22.4L/mol=0.004×22.4L��������Һ�����ʵ���Ũ���� =
= mol/L��
mol/L��
�ʴ�Ϊ��0.008NA��0.012mol��44.8mL�� mol/L��
mol/L��
��3����ͭΪ3mol����HNO3Ϊ10mol������ͭԪ���غ��֪����������ͭ3mol���������������õ�����Ϊ10mol-6mol=4mol��������NOΪxmol��������NO2Ϊ��4-x��mol�����ݵ���ת���غ��֪��3x+��4-x��×1=3×2�����x=1��������NOΪ1mol��������NO2Ϊ3mol����Ӧ���ӷ���ʽΪ3Cu+10H++4NO3-=3Cu2++NO��+3NO2��+5H2O��
�ʴ�Ϊ��3Cu+10H++4NO3-=3Cu2++NO��+3NO2��+5H2O��
��4���÷�Ӧ��������������ԭ��Ӧ�����ߵı����������������������Է����仯��
�ʴ�Ϊ���÷�Ӧ��������������ԭ��Ӧ�����ߵı����������������������Է����仯��
���������鷴Ӧ����ʽ���йؼ��㣬�Ѷ��еȣ���3�������ӷ���ʽ����д�ؼ���NO��NO2�����ʵ�����ȷ����
��2��ͭʧȥ2�������γ�Cu2+��ʧȥ�ĵ������ʵ�����ͭ��2�����ݴ˼��㣮
���ݵ���ת���غ����NO��NO2�����ʵ���������ͭԪ���غ��������ͭ�����ʵ��������ݵ�Ԫ���غ��֪�μӷ�Ӧ����������ʵ���n��HNO3��=2n[Cu��NO3��2]+n��NO2��+n��NO����
���ݷ���ʽ4NO2+O2+2H2O=4HNO3��4NO+3O2+2H2O=4HNO3��������Ҫͨ��O2�����ʵ�����������������ʵ���������V=cVm���������������Һ�������һ��������������������֮�ͣ�����c=
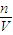 ��������Ũ�ȣ�
��������Ũ�ȣ���3����ͭΪ3mol����HNO3Ϊ10mol������ͭԪ���غ��֪����������ͭ3mol���������������õ�����Ϊ10mol-6mol=4mol��������NOΪxmol��������NO2Ϊ��4-x��mol�����õ���ת���غ��з��̼���xֵ���ݴ���д���ӷ���ʽ��
��4���÷�Ӧ��������������ԭ��Ӧ�����ߵı����������������������Է����仯��
����⣺��1����Ӧ�е�Ԫ�ػ��ϼ���+5�۽���Ϊ+2��+4�ۣ��������������ԣ�ͬʱ���������Σ������������ԣ�
�ʴ�Ϊ�������ԡ����ԣ�
��2��ͭʧȥ2�������γ�Cu2+��ʧȥ�ĵ������ʵ�����ͭ��2����0.004molCu��������ȫ�ܽ��
Cuʧȥ�ĵ�������0.004mol×2×NAmol-1=0.008NA��
����ͭԪ���غ㣬n[Cu��NO3��2]=n��Cu��=0.004mol����NO��NO2�����ʵ���Ϊymol��
���ݵ���ת���غ���3y+y=0.004×2�����y=0.002�����ݵ�Ԫ���غ��֪���μӷ�Ӧ����������ʵ���
n��HNO3��=2n[Cu��NO3��2]+n��NO2��+n��NO��=0.004mol×2+0.002mol+0.002mol=0.012mol��
���ݷ���ʽ4NO2+O2+2H2O=4HNO3��4NO+3O2+2H2O=4HNO3��֪����Ҫͨ��O2�����ʵ���Ϊ
0.002mol×
 +0.002mol×
+0.002mol× =0.002mol��������������ʵ���Ϊ0.002mol+0.002mol=0.004mol��������Ҫ���������Ϊ
=0.002mol��������������ʵ���Ϊ0.002mol+0.002mol=0.004mol��������Ҫ���������Ϊ0.002mol×22.4L/mol=0.0448L=44.8ml����Һ�������һ��������������������֮�ͣ�������Һ�����Ϊ
0.004mol×22.4L/mol=0.004×22.4L��������Һ�����ʵ���Ũ����
 =
= mol/L��
mol/L���ʴ�Ϊ��0.008NA��0.012mol��44.8mL��
 mol/L��
mol/L����3����ͭΪ3mol����HNO3Ϊ10mol������ͭԪ���غ��֪����������ͭ3mol���������������õ�����Ϊ10mol-6mol=4mol��������NOΪxmol��������NO2Ϊ��4-x��mol�����ݵ���ת���غ��֪��3x+��4-x��×1=3×2�����x=1��������NOΪ1mol��������NO2Ϊ3mol����Ӧ���ӷ���ʽΪ3Cu+10H++4NO3-=3Cu2++NO��+3NO2��+5H2O��
�ʴ�Ϊ��3Cu+10H++4NO3-=3Cu2++NO��+3NO2��+5H2O��
��4���÷�Ӧ��������������ԭ��Ӧ�����ߵı����������������������Է����仯��
�ʴ�Ϊ���÷�Ӧ��������������ԭ��Ӧ�����ߵı����������������������Է����仯��
���������鷴Ӧ����ʽ���йؼ��㣬�Ѷ��еȣ���3�������ӷ���ʽ����д�ؼ���NO��NO2�����ʵ�����ȷ����

��ϰ��ϵ�д�
�����Ŀ

 4NO+6H2O
4NO+6H2O +HNO3��Ũ��
+HNO3��Ũ�� -NO2+H2O
-NO2+H2O