题目内容
(1)黄铁矿(FeS2)是制造硫酸的矿物原料,反应历程为FeS2→SO2→SO3→H2SO4,请写出SO2制备SO3反应的化学方程式,并用双线桥标出电子转移的方向和数目______;
(2)下列酸在与黄铁矿(FeS2)发生反应时,其中S或N元素的化合价不会发生变化的是______;
a.稀硫酸b.稀硝酸c.浓硫酸d.浓硝酸
(3)从矿物学资料查得,自然界存在反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,该反应的氧化剂为______,反应中转移的电子数为______;
(4)将(2)中反应的产物溶于水后过滤(Cu2S不溶于水和稀酸),再将滤液滴入用硫酸酸化的高锰酸钾溶液中发现溶液褪色,已知反应后锰元素呈+2价,请写出反应的化学方程式______.
(2)下列酸在与黄铁矿(FeS2)发生反应时,其中S或N元素的化合价不会发生变化的是______;
a.稀硫酸b.稀硝酸c.浓硫酸d.浓硝酸
(3)从矿物学资料查得,自然界存在反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,该反应的氧化剂为______,反应中转移的电子数为______;
(4)将(2)中反应的产物溶于水后过滤(Cu2S不溶于水和稀酸),再将滤液滴入用硫酸酸化的高锰酸钾溶液中发现溶液褪色,已知反应后锰元素呈+2价,请写出反应的化学方程式______.
(1)SO2制备SO3反应中,S元素的化合价由+4价升高为+6价,O元素的化合价由0降低为-2价,该反应及转移电子方向和数目为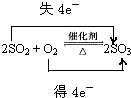 ,
,
故答案为: ;
;
(2)S或N元素的化合价不会发生变化,则与非强氧化性酸反应,只有a为非强氧化性酸,故答案为:a;
(3)14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4中,Cu、S元素的化合价降低,则氧化剂为CuSO4 、FeS2;S元素的化合价由-1价升高为+6价,由S原子守恒可知,有3个S原子失去电子,则转移电子为3×[6-(-1)]=21,
故答案为:CuSO4 、FeS2;21;
(4)由信息可知,硫酸亚铁与高锰酸钾发生氧化还原反应,该反应为10FeSO4+2KMnO4+8H2SO4=5Fe2(SO4)3+2MnSO4+K2SO4+8H2O,
故答案为:10FeSO4+2KMnO4+8H2SO4=5Fe2(SO4)3+2MnSO4+K2SO4+8H2O.
 ,
,故答案为:
 ;
; (2)S或N元素的化合价不会发生变化,则与非强氧化性酸反应,只有a为非强氧化性酸,故答案为:a;
(3)14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4中,Cu、S元素的化合价降低,则氧化剂为CuSO4 、FeS2;S元素的化合价由-1价升高为+6价,由S原子守恒可知,有3个S原子失去电子,则转移电子为3×[6-(-1)]=21,
故答案为:CuSO4 、FeS2;21;
(4)由信息可知,硫酸亚铁与高锰酸钾发生氧化还原反应,该反应为10FeSO4+2KMnO4+8H2SO4=5Fe2(SO4)3+2MnSO4+K2SO4+8H2O,
故答案为:10FeSO4+2KMnO4+8H2SO4=5Fe2(SO4)3+2MnSO4+K2SO4+8H2O.

练习册系列答案
相关题目