题目内容
(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所至;乙同学认为是溶液中Na2CO3电离出的CO32—水解所至。请你设计一个简单的实验方案给甲和乙两位
同学的说法以评判(包括操作、现象和结论)
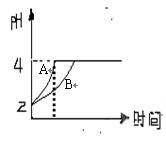
(2)常温下,取pH=2的盐酸和醋酸溶液各10![]() 0mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化曲线的是 (填“A”或“B”)。设盐酸中加入的Zn质量为m1, 醋酸溶液中加入的Zn质量为m2。则m1 m2(选填“<”、“=”、“>”)
0mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化曲线的是 (填“A”或“B”)。设盐酸中加入的Zn质量为m1, 醋酸溶液中加入的Zn质量为m2。则m1 m2(选填“<”、“=”、“>”)
(1)向红色溶液中加入足量BaCl2溶液,如果溶液显红色,说明甲正确,如果红色退去,说明乙正确。
(2)B;<
解析:
⑴方法一:向红色溶液中加入足量BaCl2溶液,如果溶液显红色,说明甲正确,如果红色退去,说明乙正确;方法二:加热,如果红色不变说明甲正确,如果红色加深,说明乙正确。
⑵由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线。由图知盐酸和醋酸的pH变化都是由2到4,但醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2。

练习册系列答案
相关题目
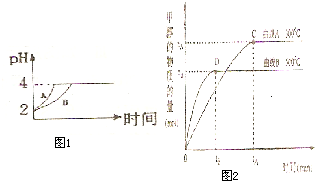 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题: AgOH+H+
AgOH+H+
 门上的固体材料R可以采用
门上的固体材料R可以采用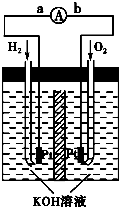 方向为
方向为 (2010?定海区模拟)I.(1)室温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是
(2010?定海区模拟)I.(1)室温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是