��Ŀ����
һ�������£�ʹX(g)��Y(g)��2L�ܱ������з�����Ӧ����z(g)���¶�ΪTKʱ����Ӧ������X,Y,Z�����ʵ����仯��ͼ1��ʾ�������������������䣬�¶ȷֱ�ΪT, K��T2 Kʱ��Y�����������ʱ��Ĺ�ϵ��ͼ2��ʾ�������н�����ȷ����
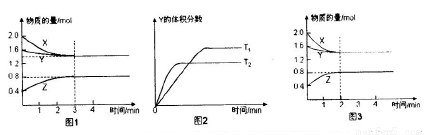
A����Ӧ���е�ǰ3 min�ڣ���X��ʾ�ķ�Ӧ����V(X)=0��1 mol/(L��min)
B��ƽ��ʱ�����ڵ�ѹǿΪ��Ӧǰ��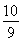 ��
��
C�����������������䣬�����¶ȣ���Ӧ�Ļ�ѧƽ�ⳣ��K��С
D�����ı䷴Ӧ������ʹ��Ӧ������ͼ3��ʾ����ı������������ѹǿ
A
��������
���������A����Ӧ���е�ǰ3 min�ڣ���X��ʾ�ķ�Ӧ����V(X)=(2��0-1��4)mol��2L��3min=0��1 mol/(L��min)����ȷ��B��������һ��������ܱ������з����ķ�Ӧ��˵�������������ѹǿ�ȵ�����������ʵ����ıȡ��ڷ�Ӧǰ��������ʵ���Ϊ��2��0��1��8��0��4=4mol����ƽ��ʱ��������ʵ���ΪX��1��4mol�� Y��1��4mol�� Z ��0��8mol��n(����)=3��6mol��n(ƽ��)��n(ǰ)=3��6��4= �����ƽ��ʱ�����ڵ�ѹǿΪ��Ӧǰ��
�����ƽ��ʱ�����ڵ�ѹǿΪ��Ӧǰ�� ��������C����ͼ2���Կ�����T2>T1�������¶ȣ�Y�ĺ�����С��˵�������¶ȣ���ѧƽ��������Ӧ�����ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ���������Ӧ����Ϊ���ȷ�Ӧ�����Ա��������������䣬�����¶ȣ��÷�Ӧ�Ļ�ѧƽ�ⳣ��K������D������ͼ1��֪�÷�Ӧ�ķ���ʽΪ3X+Y
��������C����ͼ2���Կ�����T2>T1�������¶ȣ�Y�ĺ�����С��˵�������¶ȣ���ѧƽ��������Ӧ�����ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ���������Ӧ����Ϊ���ȷ�Ӧ�����Ա��������������䣬�����¶ȣ��÷�Ӧ�Ļ�ѧƽ�ⳣ��K������D������ͼ1��֪�÷�Ӧ�ķ���ʽΪ3X+Y 2Z�����ڸı�������Ӧ���ʼӿ죬�ﵽƽ������Ҫ��ʱ�����̡���ƽ��ʱ����ֵĺ������ֲ��䡣���Ըı�������Ǽ������������
2Z�����ڸı�������Ӧ���ʼӿ죬�ﵽƽ������Ҫ��ʱ�����̡���ƽ��ʱ����ֵĺ������ֲ��䡣���Ըı�������Ǽ������������
���㣺���黯ѧ��Ӧ���ʵļ��㡢��������Ի�ѧƽ���Ӱ���֪ʶ��

 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�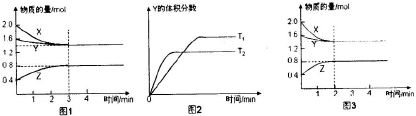
| A����Ӧ���е�ǰ3min�ڣ���X��ʾ�ķ�Ӧ����V��X��=0.1mol/��L?min�� | B��ƽ��ʱ�����ڵ�ѹǿΪ��Ӧǰ��0.8�� | C�����������������䣬�����¶ȣ���Ӧ�Ļ�ѧƽ�ⳣ��K��С | D�����ı䷴Ӧ������ʹ��Ӧ������ͼ3��ʾ����ı������������ѹǿ |
��13�֣�
�� ij�¶��£��ܱ������г���1 mol N2��3 mol H2��ʹ֮��Ӧ�ϳ�NH3��ƽ����NH3���������Ϊw������¶Ȳ��䣬ֻ�ı���ʼ��������ʹ֮��Ӧƽ���NH3�����������Ϊw��N2��H2��NH3�����ʵ����ֱ���x��y��z��ʾ��
��1�����º��������£���x��0.75 mol, ��y��________�� z��________.
��2�����º�ѹ�����£�x��y��z������С��0�������һ��������_______________________��
�� һ�������£����淴ӦX(g)+Y(g) 2Z(g)�ﵽƽ��ʱ�������ʵ�ƽ��Ũ��Ϊc(X)=0.5mol/L��c(Y)=0.1 mol /L ; c (Z)=1.6 mol /L����a���⡢�㡡�ֱ��ʾX��Y�� Z�ij�ʼŨ�ȣ�mol/L����ᡢ��Ӧ����Ĺ�ϵ��________ ____, a��ȡֵ��ΧΪ_______________
�� ��10���4��105Pa�������£�����ӦaA(g) dD(g)��eE(g)������ƽ���ά���¶Ȳ����ѹǿ�ı䣬���D��Ũ�ȱ仯���£�
| ѹǿ��Pa�� | 4��105 | 6��105 | 10��105 | 20��105 |
| D��Ũ�ȣ�mol/L�� | 0.085 | 0.126 | 0.200 | 0.440 |
��1��ѹǿ��4��105Pa���ӵ�6��105Paʱ��ƽ���� ����������桱�������ƶ���������_________________________________________________________________
��2��ѹǿ��10��105Pa���ӵ�20��105Paʱ��ƽ����_______����������桱�������ƶ�
��13�֣�
�� ij�¶��£��ܱ������г���1 mol N2��3 mol H2��ʹ֮��Ӧ�ϳ�NH3��ƽ����NH3���������Ϊw������¶Ȳ��䣬ֻ�ı���ʼ��������ʹ֮��Ӧƽ���NH3�����������Ϊw��N2��H2��NH3�����ʵ����ֱ���x��y��z��ʾ��
��1�����º��������£���x��0.75 mol, ��y��________�� z��________.
��2�����º�ѹ�����£�x��y��z������С��0�������һ��������_______________________��
�� һ�������£����淴ӦX(g)+Y(g)  2Z(g)�ﵽƽ��ʱ�������ʵ�ƽ��Ũ��Ϊc(X)=0.5mol/L��c(Y)
=0.1 mol /L ; c (Z)=1.6 mol /L����a���⡢�㡡�ֱ��ʾX��Y�� Z�ij�ʼŨ�ȣ�mol/L����ᡢ��Ӧ����Ĺ�ϵ��________ ____, a��ȡֵ��ΧΪ_______________
2Z(g)�ﵽƽ��ʱ�������ʵ�ƽ��Ũ��Ϊc(X)=0.5mol/L��c(Y)
=0.1 mol /L ; c (Z)=1.6 mol /L����a���⡢�㡡�ֱ��ʾX��Y�� Z�ij�ʼŨ�ȣ�mol/L����ᡢ��Ӧ����Ĺ�ϵ��________ ____, a��ȡֵ��ΧΪ_______________
�� ��10���4��105Pa�������£�����ӦaA(g)  dD(g)��eE(g)������ƽ���ά���¶Ȳ����ѹǿ�ı䣬���D��Ũ�ȱ仯���£�
dD(g)��eE(g)������ƽ���ά���¶Ȳ����ѹǿ�ı䣬���D��Ũ�ȱ仯���£�
|
ѹǿ��Pa�� |
4��105 |
6��105 |
10��105 |
20��105 |
|
D��Ũ�ȣ�mol/L�� |
0.085 |
0.126 |
0.200 |
0.440 |
��1��ѹǿ��4��105Pa���ӵ�6��105Paʱ��ƽ���� ����������桱�������ƶ���������_________________________________________________________________
��2��ѹǿ��10��105Pa���ӵ�20��105Paʱ��ƽ����_______����������桱�������ƶ�
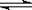 2Z(g)+W(s)����H<0�ķ�Ӧ���̡���ʹa���߱�Ϊb���ߣ��ɲ��õĴ�ʩ��
2Z(g)+W(s)����H<0�ķ�Ӧ���̡���ʹa���߱�Ϊb���ߣ��ɲ��õĴ�ʩ��