题目内容
下列叙述不正确的是
| A.通过单质Fe与Cl2、S反应的产物可以判断Cl2和S的氧化性强弱 |
| B.向饱和Ca(OH)2溶液中加入一小块钠,溶液中有固体析出 |
| C.浓硫酸在常温下能够使铁、铝等金属钝化 |
| D.干燥的氯气可使湿润的pH试纸退色,说明Cl2具有漂白性 |
D
解析试题分析:A.由于单质Fe与Cl2生成铁的高价化合物三氯化价,而与S反应的产物是硫化亚铁是铁的低价化合物,故可以判断Cl2和S的氧化性强弱,正确;B.向饱和Ca(OH)2溶液中加入一小块钠,钠和水发生了反应,减小了溶剂,同进增加了氢氧根离子的浓度,溶液中会有固体氢氧化钙析出,正确;C.浓硫酸在常温下能够使铁、铝等金属钝化,正确;D.干燥的氯气与到湿润的pH试纸时是和水反应生成了次氯酸,次氯酸有具有漂白性,错误;
考点:考查氧化性强弱的判断和氢氧化钙的溶解性,次氯酸的极漂白性等相关知识。

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
下列实验或生产操作,其中没有新物质生成的是
①蛋白质溶液中加入硫酸铵后形成沉淀
②碘化银用于人工降雨
③二氧化氮经加压凝成无色液体
④溴水滴入植物油中振荡褪色
⑤水泥、砂子和水混合后硬化
⑥除去混在氢氧化铁胶体中的氯化铁
| A.①②③ | B.②④⑥ | C.③⑤ | D.①⑥ |
下列化合物,不能通过单质之间反应直接制得的是( )
| A.FeCl3 | B.FeCl2 | C.Na2O2 | D.CuCl2 |
下列各项中,理由、结论及因果关系均正确的是
| 选项 | 理由 | 结论 |
| A | 相同物质的量浓度溶液的pH:BaCl2>MgCl2 | 碱性:Ba(OH)2>Mg(OH)2 |
| B | 相同物质的量的原子失去电子的数目:Al>Na | 还原性:Al>Na |
| C | 相同数目的分子中可电离的H+数:H2SO4>HClO | 酸性:H2SO4>HClO |
| D | 相同物质的量得到电子的数目:稀硝酸>浓硝酸 | 氧化性:稀硝酸>浓硝酸 |
下列说法在一定条件下可以实现的是( )
①酸性氧化物与碱发生反应
②弱酸与盐溶液反应可以生成强酸
③没有水生成,也没有沉淀和气体生成的复分解反应
④两种酸充分反应后溶液体系为中性
⑤有单质参加的非氧化还原反应
⑥两种氧化物反应有气体生成
| A.①②③④⑤⑥ | B.除⑥外 | C.除④外 | D.除②外 |
下列物质与其用途完全符合的有( )条
①CaCO3—制玻璃; ② SiO2—制光导纤维; ③AgBr—照相底片感光剂;
④NaCl—制纯碱; ⑤ Al2O3—焊接钢轨; ⑥NaClO—消毒剂;
⑦Fe2O3—红色油漆; ⑧MgO—耐火材料
| A.5 | B.6 | C.7 | D.8 |
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 | 叙述I | 叙述II |
| A | NH4Cl加热有类似升华现象 | 用加热法除去NaCl中的NH4Cl |
| B | Fe的金属活动性大于Cu | 用FeCl3溶液可以腐蚀Cu |
| C | 水解程度:NaHCO3<Na2CO3 | 溶解度:Na2CO3>NaHCO3 |
| D | HNO3具有不稳定性 | 浓HNO3应保存在棕色试剂瓶中 |

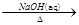 NaAlO2(aq)
NaAlO2(aq)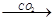 Al(OH)3
Al(OH)3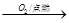 SO3
SO3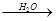 H2SO4
H2SO4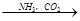 NaHCO3
NaHCO3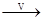 Na2CO3
Na2CO3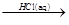 FeCl3
FeCl3