题目内容
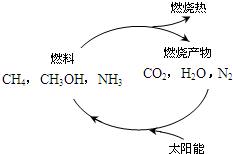 能源是当今社会发展的三大支柱之一.
能源是当今社会发展的三大支柱之一.(1)天然气是一种高效、低耗、污染小的清洁能源,主成分为甲烷,甲烷燃烧的化学方程式为:
(2)原电池是一种将化学能转化为电能的装置,现有如下两个反应:
A.NaOH+HCl=NaCl+H2O B.2FeCl3+Cu=2FeCl2+CuCl2
①反应A不能设计成原电池的理由是
②利用反应B设计成一个原电池,则负极材料为
分析:(1)甲烷燃烧生成二氧化碳和水,依据能量守恒分析判断,根据图可知,太阳能首先转化为化学能,其次化学能转化为热能;
(2)①原电池的本质反应是氧化还原反应才能设计成原电池;
②原电池中失电子的物质在负极发生氧化反应,电子流向负极经导线流向正极;
(2)①原电池的本质反应是氧化还原反应才能设计成原电池;
②原电池中失电子的物质在负极发生氧化反应,电子流向负极经导线流向正极;
解答:解:(1)甲烷燃烧生成二氧化碳和水,反应的化学方程式为:CH4+3O2
CO2+2H2O;燃烧反应是放热反应,反应为能量高于生成物,根据图可知,太阳能首先转化为化学能,其次化学能转化为热能;
故答案为:(1)CH4+3O2
CO2+2H2O;大于;化学;
(2)①NaOH+HCl=NaCl+H2O,反应是复分解反应,无元素化合价变化,不能产生电子转移,不能设计原电池;
故答案为:不是自发的氧化还原反应;
②2FeCl3+Cu=2FeCl2+CuCl2,反应是氧化还原反应,铜失电子发生氧化反应做原电池负极,电子流向是从铜流出,沿导线流向正极石墨;
故答案为:铜;电从负极铜电极沿导线流向正极石墨电极;
| 点燃 |
故答案为:(1)CH4+3O2
| 点燃 |
(2)①NaOH+HCl=NaCl+H2O,反应是复分解反应,无元素化合价变化,不能产生电子转移,不能设计原电池;
故答案为:不是自发的氧化还原反应;
②2FeCl3+Cu=2FeCl2+CuCl2,反应是氧化还原反应,铜失电子发生氧化反应做原电池负极,电子流向是从铜流出,沿导线流向正极石墨;
故答案为:铜;电从负极铜电极沿导线流向正极石墨电极;
点评:本题考查原电池原理的分析判断,能量转化的分析应用,题目较简单.

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
 能源是当今社会发展的三大支柱之一.有专家指出:如果对燃烧产物如CO2、H2O、N2等能够实现利用太阳能让它们重新组合(如右图),可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化为( )
能源是当今社会发展的三大支柱之一.有专家指出:如果对燃烧产物如CO2、H2O、N2等能够实现利用太阳能让它们重新组合(如右图),可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化为( )

