题目内容
相同条件下,向100mL,pH=1的硫酸、醋酸、盐酸溶液中分别加入0.46gNa,产生氢气的体积分别为V1、V2、V3,则下列关系中,正确的是( )A.V3<V2<V1
B.V3=V2=V1
C.V1=V3>V2
D.V1=V3<V2
【答案】分析:pH=1的硫酸、醋酸、盐酸溶液中,c(H2SO4)=0.05mol/L,c(HCl)=0.1mol/L,c(HAc)>0.1mol/L,n(Na)= =0.02mol,无论酸是否过量或不足,由2Na+2H2O═2OH-+2Na++H2↑可知,Na完全反应,则生成的氢气相同,以此来解答.
=0.02mol,无论酸是否过量或不足,由2Na+2H2O═2OH-+2Na++H2↑可知,Na完全反应,则生成的氢气相同,以此来解答.
解答:解:n(Na)= =0.02mol,pH=1的硫酸、醋酸、盐酸溶液中,
=0.02mol,pH=1的硫酸、醋酸、盐酸溶液中,
无论酸是否过量或不足,由2Na+2H2O═2OH-+2Na++H2↑可知,Na完全反应,则生成的氢气相同,
所以V3=V2=V1,
故选B.
点评:本题考查酸与金属的反应,明确Na与水的反应是解答本题的关键,易错选D,题目难度不大.
 =0.02mol,无论酸是否过量或不足,由2Na+2H2O═2OH-+2Na++H2↑可知,Na完全反应,则生成的氢气相同,以此来解答.
=0.02mol,无论酸是否过量或不足,由2Na+2H2O═2OH-+2Na++H2↑可知,Na完全反应,则生成的氢气相同,以此来解答.解答:解:n(Na)=
 =0.02mol,pH=1的硫酸、醋酸、盐酸溶液中,
=0.02mol,pH=1的硫酸、醋酸、盐酸溶液中,无论酸是否过量或不足,由2Na+2H2O═2OH-+2Na++H2↑可知,Na完全反应,则生成的氢气相同,
所以V3=V2=V1,
故选B.
点评:本题考查酸与金属的反应,明确Na与水的反应是解答本题的关键,易错选D,题目难度不大.

练习册系列答案
相关题目
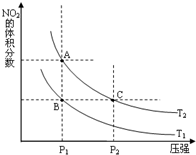 氮可形成多种氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互转化.
氮可形成多种氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互转化.(1)对反应2NO2(g)?N2O4(g)△H=-57.2kJ?mol-1
①在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.T1
②A、C两点气体的平均相对分子质量:A
(2)在100℃时,将0.40mol的NO2气体充入2L的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②该条件下平衡常数K的值为
③若其他条件不变,下列既能加快正反应速率又能提高NO2转化率的措施是
④若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始的物质的量是
⑤若其它条件不变,只将容器改为带活塞的恒压容器,则平衡时N2O4的量
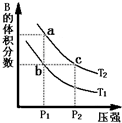 对于反应A(g)?2B(g)△H>0,在温度为T1、T2时,平衡体系中B的体积分数随压强变化的曲线如图所示.回答下列各题.
对于反应A(g)?2B(g)△H>0,在温度为T1、T2时,平衡体系中B的体积分数随压强变化的曲线如图所示.回答下列各题.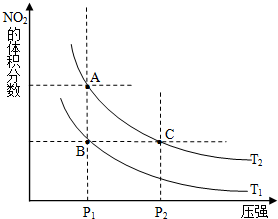 氮可形成多种氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互转化.
氮可形成多种氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互转化.