题目内容
13.T℃时,将5mol A和7mol B气体通入体积为10L的密闭容器中(容积不变),反应过程中A、B、C浓度变化如图1所示.若保持其他条件不变,温度分别为T1和T2时,B 的体积分数与时间的关系如图2所示: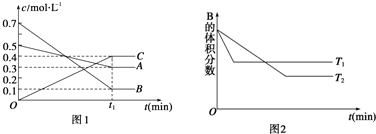
则下列结论正确的是( )
| A. | T℃时,将4 mol A,4 mol B和2 mol C气体通入体积为10 L的密闭容器中(容积不变),达到平衡时,C的浓度为0.4 mol•L-1 | |
| B. | 保持其他条件不变,在(t1+10)min时,加入催化剂,平衡向正反应方向移动 | |
| C. | 保持其他条件不变,在(t1+10)min时,通入稀有气体,平衡向逆反应方向移动 | |
| D. | 保持其他条件不变,升高温度,正、逆反应速率均增大,A的转化率也增大 |
分析 该反应达到平衡状态时,A浓度的变化量=(0.5-0.3)mol/L=0.2mol/L,B浓度的变化量=(0.7-0.1)mol/L=0.6mol/L,C浓度的变化量=(0.4-0)mol/L=0.4mol/L,同一化学反应同一时间段内,各物质浓度的变化量之比等于其计量数之比,所以该反应方程式为:A(g)+3B(g)?2C(g),
根据“先拐先平数值大”结合图II知,T1>T2,升高温度,B的体积发生增大,则该反应的正反应是放热反应;
A.先根据图I计算平衡常数,再根据平衡常数计算改变三种物质的浓度达到平衡状态时Z的浓度;
B.催化剂只改变反应速率,不改变平衡移动;
C.密闭容器中,通入稀有气体,各物质的浓度不变,平衡不移动;
D.其它条件不变,升高温度,正逆反应速率都增大,平衡向吸热反应方向移动.
解答 解:反应达到平衡状态时,A浓度的变化量=(0.5-0.3)mol/L=0.2mol/L,B浓度的变化量=(0.7-0.1)mol/L=0.6mol/L,C浓度的变化量=(0.4-0)mol/L=0.4mol/L,同一化学反应同一时间段内,各物质浓度的变化量之比等于其计量数之比,所以该反应方程式为:A(g)+3B(g)?2C(g),根据“先拐先平数值大”结合图II知,T1>T2,升高温度,B的体积发生增大,则该反应的正反应是放热反应;
A.根据图I知,化学平衡常数K=$\frac{(0.4){\;}^{2}}{0.3×(0.1){\;}^{3}}$,
假设C的平衡浓度是0.4mol/L,
A(g)+3B(g)?2C(g),
开始(mol/L)0.4 0.4 0.2
反应(mol/L)0.1 0.3 0.2
平衡(mol/L) 0.3 0.1 0.4
化学平衡常数K′=$\frac{(0.4){\;}^{2}}{0.3×(0.1){\;}^{3}}$,所以符合平衡常数K,故A正确;
B.因为催化剂只改变反应速率,不改变平衡移动,所以在(t1+10)min时,加入催化剂,平衡不移动,故B错误;
C.密闭容器中,通入稀有气体,各物质的浓度不变,平衡不移动,所以在(t1+10)min时,通入稀有气体,平衡不移动,故C错误;
D.其它条件不变,升高温度,正逆反应速率都增大,平衡向吸热反应方向移动,根据图II知,正反应是放热反应,所以平衡向逆反应方向移动,A的转化率降低,故D错误;
故选A.
点评 本题考查外界条件对化学平衡移动的影响,正确确定反应方程式是解本题关键,会根据“先拐先平数值大”确定该反应是吸热反应还是放热反应,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 硝酸钾和硝酸钠 | B. | 硫酸钠和硫酸钡 | C. | 氧化铜和碳粉 | D. | 水和酒精 |
| A. | 1.5g甲基(-CH3)所含有的电子数是NA | |
| B. | 14g乙烯和丙烯的混合物中含有原子的数目为NA | |
| C. | 标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为$\frac{5}{22.4}$NA | |
| D. | 常温常压下,1mol CnH2n+2中所含有的共价键数目为(3n+1)NA |
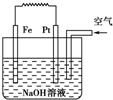
| A. | 这是电解NaOH溶液的装置 | |
| B. | 该装置中Pt为正极,电极反应为O2+2H2O+4e-→4OH- | |
| C. | 该装置中Fe为负极,电极反应为Fe+2OH-→Fe(OH)2+2e- | |
| D. | 这是一个原电池装置 |
| A. | 酸使亚氯酸的氧化性增强 | |
| B. | 溶液中的H+起催化作用 | |
| C. | 溶液中的Cl-起催化作用 | |
| D. | 逸出的ClO2使反应生成物的浓度降低 |
| A. | 碳酸钠溶液中通入少量SO2:2CO32-+SO2+H2O=2HCO3-+SO32- | |
| B. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═Fe2++I2 | |
| C. | 少量氯气通入溴化亚铁溶液中3Cl2+2Fe2++4Br-═6Cl-+2Fe3++2Br2 | |
| D. | NaHCO3溶液水解:HCO3-+H2O=H2CO3+OH- |
| A. | 石蕊试液 | B. | 品红溶液 | C. | 澄清石灰水 | D. | 氯化钡溶液 |