题目内容
某混合溶液可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现分别取三份溶液进行如下实验:
①第一份加入AgNO3溶液有白色沉淀产生
②第二份加足量NaOH溶液加热后,得到一种刺激性气味的气体
③第三份加足量BaCl2溶液后,得白色沉淀,用足量盐酸洗涤、沉淀部分溶解.
根据上述实验,对原溶液的推测不正确的是( )
①第一份加入AgNO3溶液有白色沉淀产生
②第二份加足量NaOH溶液加热后,得到一种刺激性气味的气体
③第三份加足量BaCl2溶液后,得白色沉淀,用足量盐酸洗涤、沉淀部分溶解.
根据上述实验,对原溶液的推测不正确的是( )
| A、一定含有Cl- | B、一定不含Ba2+ | C、可能含有K+ | D、一定含有CO32-和SO42- |
分析:①加入AgNO3溶液有沉淀产生,说明溶液中可能存在Cl-、CO32-、SO42-;
②加足量NaOH溶液加热后,得到一种刺激性气味的气体,则溶液中一定含有NH4+;
③加足量BaCl2溶液后,得白色沉淀,用足量盐酸洗涤、沉淀部分溶解,则溶液中一定含CO32-、SO42-,所以Ba2+与CO32-、SO42-不共存,所以不含Ba2+;
②加足量NaOH溶液加热后,得到一种刺激性气味的气体,则溶液中一定含有NH4+;
③加足量BaCl2溶液后,得白色沉淀,用足量盐酸洗涤、沉淀部分溶解,则溶液中一定含CO32-、SO42-,所以Ba2+与CO32-、SO42-不共存,所以不含Ba2+;
解答:解:①加入AgNO3溶液有沉淀产生,说明溶液中可能存在Cl-、CO32-、SO42-;
②加足量NaOH溶液加热后,得到一种刺激性气味的气体,则溶液中一定含有NH4+;
③加足量BaCl2溶液后,得白色沉淀,用足量盐酸洗涤、沉淀部分溶解,则溶液中一定含CO32-、SO42-,所以Mg2+、Ba2+与CO32-不共存,所以不含Mg2+、Ba2+;
所以一定存在的离子为NH4+、CO32-、SO42-;一定没有的离子是Mg2+、Ba2+;K+、Cl-不能确定;
故选A;
②加足量NaOH溶液加热后,得到一种刺激性气味的气体,则溶液中一定含有NH4+;
③加足量BaCl2溶液后,得白色沉淀,用足量盐酸洗涤、沉淀部分溶解,则溶液中一定含CO32-、SO42-,所以Mg2+、Ba2+与CO32-不共存,所以不含Mg2+、Ba2+;
所以一定存在的离子为NH4+、CO32-、SO42-;一定没有的离子是Mg2+、Ba2+;K+、Cl-不能确定;
故选A;
点评:本题考查常见阴、阳离子的检验,注意根据反应现象分析,难度中等.

练习册系列答案
相关题目
已知某混合金属粉末,除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验探究该混合物金属粉末中铁、铜元素的存在。仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol/L硫酸、2mol/L硝酸、2mol/LNaOH溶液、20%KSCN溶液。
完成以下实验探究过程:
(1)提出假设:
假设1 该混合金属粉末中除铝外还含有 元素;
假设2 该混合金属粉末中除铝外还含有 元素;
假设3 该混合金属粉末中除铝外还含有Fe、Cu元素;
(2)设计实验方案
基于假设3,设计出实验方案(不要在答题卡上作答)。
(3)实验过程
根据(2)的实验方案,完成实验操作、预期现象和结论的有关问题。
| 编号 | 实验操作 | 预期现象 | 结论 |
| ① | 用药匙取少许样品,加入试管A中,再用滴管取过量NaOH溶液并滴加到试管A中,充分反应后,静置,弃去上层清液,剩余固体备用 | 样品部分溶解,并有气体放出 | |
| ② | 往试管A的剩余固体中加过量稀硫酸,充分反应后,静置。取上层清液于试管B中,剩余固体备用 | 固体部分溶解,并有气体放出,溶液呈浅绿色 | 可能含 (填元素名称,以下同) |
| ③ | 往试管B中加入少许稀硝酸,再滴加KSCN溶液 | 溶液先变黄色,加KSCN后显 | 结合②可知,一定含 |
| ④ | 往②剩余固体中加入稀硝酸,再滴加NaOH溶液 | 固体溶解,有无色刺激性气体产生并很快变成红棕色,溶液显蓝色,加NaOH溶液后有 沉淀产生。 | 一定含 。 |
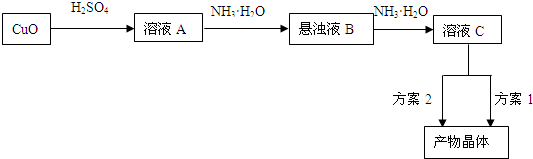
 Cu2++4NH3
Cu2++4NH3