题目内容
(2009?金华模拟)含氮废水进入水体而对环境造成的污染越来越严重.某校环保小组的同学认为可以用金属铝将水中的NO3-还原为N2,从而消除污染.
(1)配平以下有关的离子反应方程式:
(2)以上反应中,失电子的物质是
(3)现需除去1m3含氮0.3mol的废水中的NO3-(设氮元素都以NO3-的形式存在),则至少需要消耗金属铝
(4)你对以上治理污染的方案有何评价?
(1)配平以下有关的离子反应方程式:
6
6
NO3-+10
10
Al+18
18
H2O3
3
N2↑+10
10
Al(OH)3+6
6
OH-(2)以上反应中,失电子的物质是
Al
Al
,还原产物是N2
N2
,每生成1mol这种还原产物,将有10
10
摩尔电子发生转移.(3)现需除去1m3含氮0.3mol的废水中的NO3-(设氮元素都以NO3-的形式存在),则至少需要消耗金属铝
13.5
13.5
克.(4)你对以上治理污染的方案有何评价?
该方案的治理成本较高(或Al(OH)3溶于OH-会造成水体新的污染等等)
该方案的治理成本较高(或Al(OH)3溶于OH-会造成水体新的污染等等)
.分析:(1)根据电子守恒和原子守恒来配平化学方程式;
(2)氧化还原反应中,化合价升高元素失去电子,化合价降低元素对应的产物是还原产物,根据化学方程式来计算反应转移电子的量;
(3)根据化学方程式中硝酸根离子和金属铝之间的关系来计算回答;
(4)根据化学反应结合实际来回答.
(2)氧化还原反应中,化合价升高元素失去电子,化合价降低元素对应的产物是还原产物,根据化学方程式来计算反应转移电子的量;
(3)根据化学方程式中硝酸根离子和金属铝之间的关系来计算回答;
(4)根据化学反应结合实际来回答.
解答:解:(1)氯元素化合价共升高了3价,两氮元素化合价共降低了10价,根据得失电子守恒,则需要转移电子30mol,所以金属铝的前面系数是10,硝酸根前面系数是6,氮气前面系数是3,根据原子守恒配平氢原子和氧原子即可,即
6NO3-+10Al+18H2O═3N2↑+10Al(OH)3+6OH-,故答案为:6、10、18、3、10、6;
(2)氧化还原反应中,化合价升高元素Al失去电子,化合价降低的N元素对应的产物氮气是还原产物,根据化学方程式可以知道,生成3mol的氮气转移电子是30mol,当生成1mol氮气时,转移电子是10mol,故答案为:Al;N2;10;
(3)因为含氮0.3mol的废水中的NO3-的物质的量为0.3mol,根据化学方程式,0.3mol的硝酸根离子消耗金属铝的物质的量为0.5mol,所以需要金属铝的质量是:0.5mol×27g/mol=13.5g,故答案为:13.5;
(4)该方案的治理成本较高并且Al(OH)3溶于OH-会造成水体新的污染,
故答案为:该方案的治理成本较高(或Al(OH)3溶于OH-会造成水体新的污染等等).
6NO3-+10Al+18H2O═3N2↑+10Al(OH)3+6OH-,故答案为:6、10、18、3、10、6;
(2)氧化还原反应中,化合价升高元素Al失去电子,化合价降低的N元素对应的产物氮气是还原产物,根据化学方程式可以知道,生成3mol的氮气转移电子是30mol,当生成1mol氮气时,转移电子是10mol,故答案为:Al;N2;10;
(3)因为含氮0.3mol的废水中的NO3-的物质的量为0.3mol,根据化学方程式,0.3mol的硝酸根离子消耗金属铝的物质的量为0.5mol,所以需要金属铝的质量是:0.5mol×27g/mol=13.5g,故答案为:13.5;
(4)该方案的治理成本较高并且Al(OH)3溶于OH-会造成水体新的污染,
故答案为:该方案的治理成本较高(或Al(OH)3溶于OH-会造成水体新的污染等等).
点评:本题是一道有关氧化还原知识的题目,要求学生熟记教材知识,并灵活应用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
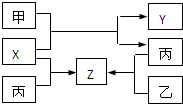 (2009?金华模拟)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物.它们之间有如下转化关系:
(2009?金华模拟)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物.它们之间有如下转化关系: