题目内容
现对0.1 mol/L的纯碱溶液进行相关研究。
(1)用pH试纸测定该溶液的pH,其正确的操作
。
(2)纯碱溶液呈碱性的原因是(用离子方程式表示) 。
(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32—离子不超过其总量的10%。请你设计实验证明该同学的观点是否正确。
。
(4)某同学根据所学知识对溶液进行分析,写出了以下四个关系式。请你判断:在正确的关系式后面打“ ”,在错误的后面写出正确的关系式。
”,在错误的后面写出正确的关系式。
① c()= 2[c(2-3 )+c(HCO-3 ) ]: ;
② c()+c(H+)= 2 c(2-3 )+c(HCO-3 )+c(OH-): ;
③ c(OH-)= c(H+)+c(HCO-3 ) +c(): ;
④ c()>c(2-3 )>c(OH-)>c(HCO-3 ) : 。
(1)把小块pH试纸放在表面皿(或玻璃片)上,用玻璃棒蘸取待测液点在试纸的中部,待试纸变色后,与标准比色卡对比确定溶液的pH 值(2分)
(2)CO32-+H2O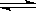 HCO3-+OH-(2分)
HCO3-+OH-(2分)
(3)用pH试纸(或pH计)测常温下0.1 mol/L纯碱溶液的pH,若pH<12,则该同学的观点正确;若pH>12,则该同学的观点不正确。(2分)
(4)① c() ===
2[c(2-3 )+c(HCO-3 ) +c()] (1分) ② (1分)
(1分)
③ c(OH-) === c(H+)+c(HCO-3 ) +2c() (1分)
④ (1分)
(1分)
【解析】略

 名校课堂系列答案
名校课堂系列答案 析,写出了以下四个关系式。请你判断:在正确的关系式后面打“
析,写出了以下四个关系式。请你判断:在正确的关系式后面打“ ”,在错误的后面写出正确的关系式。
”,在错误的后面写出正确的关系式。 ”,在错误的后面写出正确的关系式。
”,在错误的后面写出正确的关系式。