题目内容
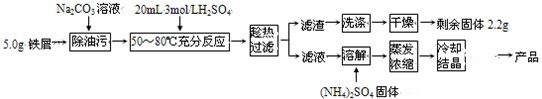 (2009?广州模拟)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2?6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂,其实验室制备流程如下:
(2009?广州模拟)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2?6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂,其实验室制备流程如下:回答下列问题:
(1)Na2CO3溶液可以除油污,原因是(用离子方程式表示)
CO32-+H2O HCO3-+OH-
HCO3-+OH-
 HCO3-+OH-
HCO3-+OH-CO32-+H2O HCO3-+OH-
HCO3-+OH-
. HCO3-+OH-
HCO3-+OH-(2)判断铁屑与硫酸基本反应完全的现象是
不再有气泡产生(或只有极少量气泡产生)
不再有气泡产生(或只有极少量气泡产生)
.(3)某同学认为铁屑与硫酸反应不需精确温度,因此不使用热水浴加热,改用酒精灯断断续续加热维持温度,该做法的不妥之处是
若控制不准确温度过高Fe2+易被氧化,由于有氢气生成,明火加热不安全.
若控制不准确温度过高Fe2+易被氧化,由于有氢气生成,明火加热不安全.
.(4)“趁热过滤”后的滤液有时略显黄色,分析其原因是(用离子方程式表示)
4Fe2++O2+4H+=4Fe3++2H2O
4Fe2++O2+4H+=4Fe3++2H2O
.(5)忽略油污质量,本实验中应称量(NH4)2SO4固体的质量为
6.6
6.6
g.(6)若上述流程用于大量生产,“冷却结晶”后的母液最佳处理方法是
循环使用
循环使用
.分析:(1)Na2CO3溶液中CO32-水解使Na2CO3溶液呈碱性,用显碱性的Na2CO3溶液洗去,铁屑表面有油污.
(2)不再有气泡产生(或只有极少量气泡产生)时,铁屑与硫酸基本反应完全.
(3)温度过高Fe2+易被氧化;由于有氢气生成,明火加热不安全.
(4)Fe2+易被氧气氧化为Fe3+.
(5)由工艺流程可知,5g铁屑中含有不溶性杂质2.2g,所以铁的质量为2.8g,物质的量为0.05mol,由硫酸亚铁铵晶体[(NH4)2Fe(SO4)2?6H2O]可知,需要0.05mol(NH4)2SO4,根据m=nM计算(NH4)2SO4固体质量.
(6)冷却结晶后的母液中含有FeSO4、(NH4)2SO4,要充分利用原料.
(2)不再有气泡产生(或只有极少量气泡产生)时,铁屑与硫酸基本反应完全.
(3)温度过高Fe2+易被氧化;由于有氢气生成,明火加热不安全.
(4)Fe2+易被氧气氧化为Fe3+.
(5)由工艺流程可知,5g铁屑中含有不溶性杂质2.2g,所以铁的质量为2.8g,物质的量为0.05mol,由硫酸亚铁铵晶体[(NH4)2Fe(SO4)2?6H2O]可知,需要0.05mol(NH4)2SO4,根据m=nM计算(NH4)2SO4固体质量.
(6)冷却结晶后的母液中含有FeSO4、(NH4)2SO4,要充分利用原料.
解答:解:(1)Na2CO3溶液中CO32-水解CO32-+H2O HCO3-+OH-,使Na2CO3溶液呈碱性,用显碱性的Na2CO3溶液洗去表面油污.
HCO3-+OH-,使Na2CO3溶液呈碱性,用显碱性的Na2CO3溶液洗去表面油污.
故答案为:CO32-+H2O HCO3-+OH-.
HCO3-+OH-.
(2)不再有气泡产生(或只有极少量气泡产生)时,说明铁屑与硫酸基本反应完全.
故答案为:不再有气泡产生(或只有极少量气泡产生).
(3)若控制不准确温度过高Fe2+易被氧化;由于有氢气生成,明火加热不安全,氢气易燃烧,容易发生危险.
故答案为:若控制不准确温度过高Fe2+易被氧化;由于有氢气生成,明火加热不安全.
(4)Fe2+易被氧气氧化为Fe3+,反应离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O.
故答案为:4Fe2++O2+4H+=4Fe3++2H2O.
(5)由工艺流程可知,5g铁屑中含有不溶性杂质2.2g,所以铁的质量为5g-2.2g=2.8g,物质的量为
=0.05mol,由硫酸亚铁铵晶体[(NH4)2Fe(SO4)2?6H2O]可知,需要0.05mol(NH4)2SO4,所以称量(NH4)2SO4固体质量为0.05mol×132g/mol=6.6g.
故答案为:6.6
(6)冷却结晶后的母液中含有FeSO4、(NH4)2SO4,要充分利用原料,所以“冷却结晶”后的母液最佳处理方法是循环使用.
故答案为:循环使用.
 HCO3-+OH-,使Na2CO3溶液呈碱性,用显碱性的Na2CO3溶液洗去表面油污.
HCO3-+OH-,使Na2CO3溶液呈碱性,用显碱性的Na2CO3溶液洗去表面油污.故答案为:CO32-+H2O
 HCO3-+OH-.
HCO3-+OH-.(2)不再有气泡产生(或只有极少量气泡产生)时,说明铁屑与硫酸基本反应完全.
故答案为:不再有气泡产生(或只有极少量气泡产生).
(3)若控制不准确温度过高Fe2+易被氧化;由于有氢气生成,明火加热不安全,氢气易燃烧,容易发生危险.
故答案为:若控制不准确温度过高Fe2+易被氧化;由于有氢气生成,明火加热不安全.
(4)Fe2+易被氧气氧化为Fe3+,反应离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O.
故答案为:4Fe2++O2+4H+=4Fe3++2H2O.
(5)由工艺流程可知,5g铁屑中含有不溶性杂质2.2g,所以铁的质量为5g-2.2g=2.8g,物质的量为
| 2.8g |
| 56g/mol |
故答案为:6.6
(6)冷却结晶后的母液中含有FeSO4、(NH4)2SO4,要充分利用原料,所以“冷却结晶”后的母液最佳处理方法是循环使用.
故答案为:循环使用.
点评:本题考查盐类水解、物质性质、物质分离提纯等有关实验操作、实验条件控制、化学计算以及综合运用知识解决问题的能力等.题目难度中等.注意基础知识的全面掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
