题目内容
(2012?茂名二模)甲、乙、丙、丁四种元素位于同一短周期,原子序数依次增加.已知:甲最外层电子数最少,丁氢化物水溶液是一种常见强酸,丙的最外层电子数是最内层电子数的两倍,下列判断正确的是( )
分析:甲、乙、丙、丁四种元素位于同一短周期,原子序数依次增加,丙的最外层电子数是最内层电子数的两倍,若为第二周期元素,则丙为C,若为第三周期元素,则丙为Si;甲最外层电子数最少,则甲为Li或Na;丁氢化物水溶液是一种常见强酸,则为第二周期时,丁为N,其氢化物的水溶液显碱性,为F时HF为弱酸,所以甲、乙、丙、丁四种元素在第三周期,甲为Na,乙为
Mg或Al,丙为Si,丁为S或Cl,然后利用元素周期律及化合物的性质来解答.
Mg或Al,丙为Si,丁为S或Cl,然后利用元素周期律及化合物的性质来解答.
解答:解:甲、乙、丙、丁四种元素位于同一短周期,原子序数依次增加,丙的最外层电子数是最内层电子数的两倍,若为第二周期元素,则丙为C,若为第三周期元素,则丙为Si;甲最外层电子数最少,则甲为Li或Na;丁氢化物水溶液是一种常见强酸,则为第二周期时,丁为N,其氢化物的水溶液显碱性,为F时HF为弱酸,所以甲、乙、丙、丁四种元素在第三周期,甲为Na,乙为Mg或Al,丙为Si,丁为S或Cl,
A.同周期从左向右原子半径在减小,则原子半径为甲>乙,故A错误;
B.同周期从左向右最外层电子数在增大,则最外层电子数为乙<丙,故B错误;
C.电解甲和丁形成化合物的水溶液得到金属对应的碱,电解熔融的化合物能得到单质,故C错误;
D.二氧化硅能与NaOH溶液反应,则丙的氧化物溶于甲的氧化物的水化物,故D正确;
故选D.
A.同周期从左向右原子半径在减小,则原子半径为甲>乙,故A错误;
B.同周期从左向右最外层电子数在增大,则最外层电子数为乙<丙,故B错误;
C.电解甲和丁形成化合物的水溶液得到金属对应的碱,电解熔融的化合物能得到单质,故C错误;
D.二氧化硅能与NaOH溶液反应,则丙的氧化物溶于甲的氧化物的水化物,故D正确;
故选D.
点评:本题考查位置、结构、性质的关系,元素的推断是解答本题的关键,熟悉同周期元素的性质及变化规律即可解答,题目难度中等.

练习册系列答案
 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
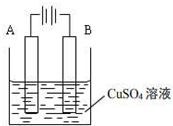 (2012?茂名二模)如图是某同学用Cu在Fe片上镀铜的实验装置,下列说法正确的是( )
(2012?茂名二模)如图是某同学用Cu在Fe片上镀铜的实验装置,下列说法正确的是( )