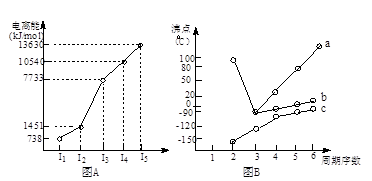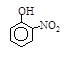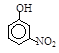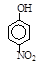题目内容
下列各组物质的性质比较正确的是
| A.酸性:HClO4>H2SO4>H3PO4 | B.稳定性:H2S>HCl>HBr>HI |
| C.碱性:KOH<NaOH<LiOH | D.熔点:SiO2>Na >NaCl |
A
非金属性越强,最高价氧化物的水化物的酸性越强,相应氢化物的温度下越强。A中非金属性逐渐减弱,正确。B中非金属性是Cl>Br>I>S,所以选项B不正确。金属性越强,最高价氧化物的水化物的碱性越强,C中金属性是K>Na>Li,C不正确。氯化钠是离子晶体,熔点大于金属钠的,D不正确,答案选A。

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
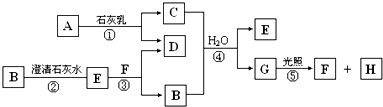
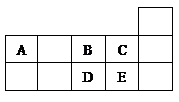
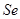 )是人体必需的微量元素,在元素周期表中的位置如下图。下列关于硒元素的叙述正确的是
)是人体必需的微量元素,在元素周期表中的位置如下图。下列关于硒元素的叙述正确的是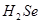 比
比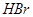 稳定
稳定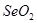
 C和
C和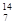 N的质量数相同,中子数不同
N的质量数相同,中子数不同