��Ŀ����
����Ŀ����2017��ɽ��ģ��Ϊ�о�ͭ��Ũ����ķ�Ӧ��ij��ѧ��ȤС���������ʵ�飮
ʵ��I����Ӧ����Ķ���̽��������ͼװ��(�̶�װ������ȥ)����ʵ�飺
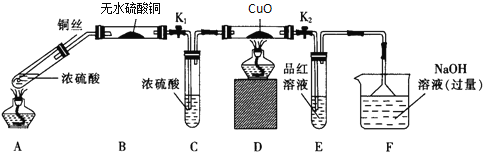
(1)Fװ�õ��ձ��з�����Ӧ�����ӷ���ʽ�� ��Bװ���е������� ��
(2)ʵ������У���֤��Ũ��������Ԫ�ص�������ǿ����Ԫ�ص������� ��
(3)ʵ�����ʱ����ȥ���оƾ���֮ǰ������ɵ�ʵ������� ��
(4)ʵ�������֤��Aװ���Թ��з�Ӧ���ò����Ƿ���ͭ���ӵIJ���������__________________________________��
ʵ��������Ӧ����Ķ���̽��
(5)��ͭ��Ũ���ᷴӦ�Ĺ����У������к�ɫ���ʳ��֣��Һ�ɫ����ΪCu2S������Cu2S�ķ�ӦΪaCu+bH2SO4![]() cCu2S+dCuSO4+e H2O����a��b= ��
cCu2S+dCuSO4+e H2O����a��b= ��
(6)Ϊ�ⶨ����ͭ�IJ��ʣ����÷�Ӧ������Һ�кͺ����Ƴ�250.00mL��Һ��ȡ����Һ25.00mL��������KI��Һ�����Ե�����ҺΪָʾ������O��36molL��1��Na2S2O3��Һ�ζ����ɵ�I2��3��ʵ��ƽ�����ĸ�Na2S2O3��Һ25.00mL������Ӧ����ͭ������Ϊ6.4g��������ͭ�IJ���Ϊ ��
(��֪2Cu2++4I��=2CuI+I2��2S2O32��+I2=S4O62��+2I��)
���𰸡�(1)SO2+2OH��=SO32��+H2O ��ɫ��ĩ����ɫ (2) Dװ���к�ɫ������ɫ�ޱ仯��Eװ������Һ��ɫ (3)����ͭ˿���ر�K1��K2 (4)��Aװ������ȴ�Ļ����Һ���ձ��ڱڻ�������ʢˮ���ձ��У������Ͻ��裬�۲��Ƿ�����ɫ���� (5)5:4 (6)90%
�����������������£�Cu��Ũ���ᷢ��������ԭ��Ӧ��������ͭ�����������ˮ��ˮ���лӷ��ԣ��¶�Խ�ӷ���Խǿ���������ɵĶ��������к���ˮ������ˮ������ʹ��ˮ����ͭ����ɫ��Ũ���������ˮ�ԣ��ܸ�������������壻�������л�ԭ�ԣ��ܽ���ɫ������ͭ��ĩ��ԭΪ��ɫCu�������������Ư���ԣ���ʹƷ����Һ��ɫ���������������������������ж�������ֱ���ſգ������ü�����Һ������
(1)�����������������������NaOH��Ӧ�����������ƺ�ˮ�����ӷ�Ӧ����ʽΪ SO2+2OH��=SO32��+H2O��ˮ���лӷ��ԣ������¶ȴٽ���ӷ����������ɵ������к���ˮ������ˮ������ʹ��ˮ����ͭ�ɰ�ɫ��Ϊ��ɫ������Bװ���е������ǣ���ɫ��ĩ����ɫ��
(2)֤��Ũ��������Ԫ�ص�������ǿ����Ԫ�أ�����Ԫ�ػ��ϼ۱仯���ɵIJ�������жϣ�������������Dװ�û��ɫ�仯Ϊ��ɫ�������ɶ�������Eװ����Ʒ�����ɫ������֤��Ũ��������Ԫ�ص�������ǿ����Ԫ�ص�ʵ�������ǣ�Dװ��������ͭ��ɫ���仯��˵�����������ɣ�Eװ����Ʒ����Һ��ɫ˵�������˶�������������
(3)ʵ�����ʱ������ͭ˿����ȥ���оƾ���֮ǰ������ɵ�ʵ������ǹر�K1��K2����ֹCE�е���Һ������ը�Ѳ����ܣ�
(4)��֤���ɵ���Һ�к���ͭ���ӣ���Ҫ���Թ��е�Һ�嵹��ˮ���ܽ⣬�۲��Ƿ������ɫ��Һ����Aװ������ȴ�Ļ����Һ���ձ��ڱڻ�������ʢˮ���ձ��У������Ͻ��裬������ɫ��Һ֤������ͭ������
(5)aCu+bH2SO4![]() cCu2S+dCuSO4+e H2O��CuԪ�ػ��ϼ���0�۱�Ϊ+1�ۡ�+2�ۡ�SԪ�ػ��ϼ���+6�۱�Ϊ��2�ۣ�ת�Ƶ�����Ϊ6������ת�Ƶ����غ㼰ԭ���غ���ƽ����ʽΪ5Cu+4H2SO4
cCu2S+dCuSO4+e H2O��CuԪ�ػ��ϼ���0�۱�Ϊ+1�ۡ�+2�ۡ�SԪ�ػ��ϼ���+6�۱�Ϊ��2�ۣ�ת�Ƶ�����Ϊ6������ת�Ƶ����غ㼰ԭ���غ���ƽ����ʽΪ5Cu+4H2SO4![]() Cu2S+3CuSO4+4H2O������a�Ub=5�U4��
Cu2S+3CuSO4+4H2O������a�Ub=5�U4��
(6)����2Cu2++4I��=2CuI+I2��2S2O32��+I2=S4O62��+2I����2Cu2+��I2��2S2O32����
���Ƶõ���Һ������ͭ�����ʵ���Ũ��Ϊxmol/L��
2Cu2+��I2��2S2O32����
2mol 2mol
0.025xmol (0.36��0.025)mol
2molL��2mol=0.025xmol��(0.36��0.025)mol
x=![]() =0.36��
=0.36��
��250mL��Һ��n(Cu2+)=0.36mol/L��0.25L=0.09mol���μӷ�Ӧ��n(Cu)=![]() =0.1mol��
=0.1mol��
������ͭ�IJ���=![]() =90%��
=90%��