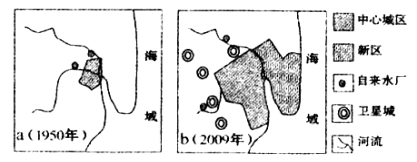
题目内容
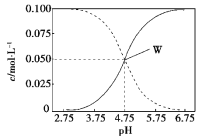
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数lgc(M2+)与溶液pH的变化关系如图所示,已知:该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。下列说法正确的是
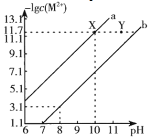
A.b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=1015.1
B.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+)∶c(Cu2+)=1∶104.6
C.向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
D.除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO
【答案】A
【解析】本题考查了难溶电解质的溶解平衡。由图像可知,当pH值都为10时,a曲线对应的M2+的浓度小于b曲线对应的M2+的浓度,说明b曲线对应物质的溶解度大,所以b曲线表示Fe(OH)2饱和溶液中的变化关系,a曲线表示Cu(OH)2的饱和溶液中的变化关系,当pH值等于8时,氢氧根离子浓度为106,lgc(M2+)=13.1,则Fe2+的浓度为1013.1,Ksp[Fe(OH)2]= 103.1×(106)2=1015.1,故A正确。当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+)∶c(Cu2+)= =
=![]() ,当pH值等于10时,氢氧根离子浓度为104,lgc(M2+)=3.1,则Fe2+的浓度为103.1,Ksp[Cu(OH)2] = 1013.1×(104)2=1021.1,Ksp[Fe(OH)2]= 103.1×(106)2=1015.1,所以c(Fe2+):c(Cu2+)=
,当pH值等于10时,氢氧根离子浓度为104,lgc(M2+)=3.1,则Fe2+的浓度为103.1,Ksp[Cu(OH)2] = 1013.1×(104)2=1021.1,Ksp[Fe(OH)2]= 103.1×(106)2=1015.1,所以c(Fe2+):c(Cu2+)=![]() =
=![]() =106,故B错。向X点对应的饱和溶液中加入少量NaOH,氢氧根离子浓度增大,平衡Fe(OH)2(s)
=106,故B错。向X点对应的饱和溶液中加入少量NaOH,氢氧根离子浓度增大,平衡Fe(OH)2(s)![]() Fe2+(aq)+2OH逆向移动,亚铁离子浓度减小,而Y点氢氧根离子浓度增大,亚铁离子浓度不变,故C错。含有的少量Fe2+的CuSO4溶液中铜离子浓度大,亚铁离子浓度小,加入适量CuO可中和氢离子使溶液中氢氧根离子浓度增大,但由于Ksp[Cu(OH)2]<Ksp[Fe(OH)2],则氢氧化铜的溶解度小于氢氧化亚铁,所以加入适量CuO,氢氧化铜首先沉淀,而氢氧化亚铁不能沉淀,故D错。
Fe2+(aq)+2OH逆向移动,亚铁离子浓度减小,而Y点氢氧根离子浓度增大,亚铁离子浓度不变,故C错。含有的少量Fe2+的CuSO4溶液中铜离子浓度大,亚铁离子浓度小,加入适量CuO可中和氢离子使溶液中氢氧根离子浓度增大,但由于Ksp[Cu(OH)2]<Ksp[Fe(OH)2],则氢氧化铜的溶解度小于氢氧化亚铁,所以加入适量CuO,氢氧化铜首先沉淀,而氢氧化亚铁不能沉淀,故D错。