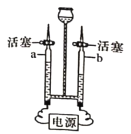
【题目】某化学兴趣小组开启寻镁之旅,现邀请你参与并完成相关内容。
第一站:初识金属镁。
(1)金属镁的物理性质:_____________(写一条)。
(2)金属镁的化学性质:镁能与氧气反应,反应的化学方程式为_______________。
第二站:再遇金属镁。
探究镁与盐酸反应过程中的能量变化以及反应速率的变化。
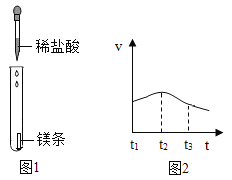
(1)实验时需将镁条进行打磨,其目的是_____________。
(2)如图1将稀盐酸逐滴滴入。放有镁条的试管中,反应中试管外壁发烫,说明镁与稀盐酸反应是_______反应(填“吸热”或“放热”),化学方程式为____________。
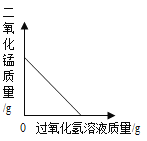
(3)实验测得镁片产生气体的速率(v)与时间(t)的关系如图2所示,则t1-t2时间内反应速率逐渐加快的主要原因是____________。
第三站:再探金属镁
(提出问题)金属镁能否与热水反应?如果反应,产物是什么?
(相关信息)①氢氧化镁在热水中能部分溶解,其溶液显碱性,在常温下不溶于水:
②无色酚酞遇碱性溶液变红。
(实验探究)填写下表:
实验操作 | 实验现象 | 实验结论 |
_______________ | 气体被点燃,发出淡蓝色火焰 | 镁能与热水反应生成氢气 |
______________ | ___________ | 镁能与热水反应生成氢化镁 |
根据以上实验,写出该反应的化学方程式___________。
第四站:实验总结应用。
总结上述寻镁之旅中你收获到镁的化学性质有____________(要写全)。金属镁有广泛用途,请举一例_________。