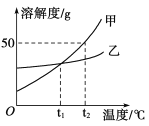
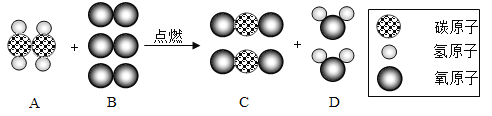
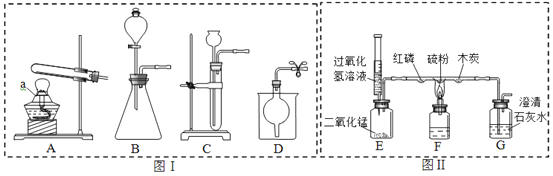
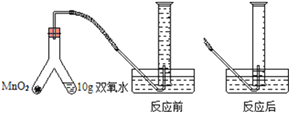
【题目】为了测定某医用双氧水中H2O2的浓度,某兴趣小组取10g样品设计如图装置进行实验(实验在常温下进行,O2在水中的溶解情况忽略不计,密度为1.43g/L),实验数据如下:
时间/s | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | 110 |
量筒 读数/mL | 0 | 32 | 60 | 80 | 90 | 95 | 98 | 100 | 98 | 94 | 90 | 90 |
(1)实验开始,将MnO2和双氧水混合,操作方法是______。
(2)反应结束,共制得氧气______mL。
(3)列式计算双氧水中H2O2的溶质质量分数___。(保留到0.01%)
(4)根据表中数据,画出产生O2的体积随时间的变化关系____;70s后测得气体体积逐渐变小的原因是:______。

【题目】Na2CO3和NaHCO3有相似的化学性质,都能与酸、某些碱反应。但碳酸钠稳定,而 NaHCO3受热分解:2NaHCO3![]() X+H2O+CO2↑。
X+H2O+CO2↑。
(1)生成物X的化学式为______。
(2)工业上用碳酸钠制烧碱的化学反应方程式为______。
(3)同学们在探究其化学性质实验后,将剩余固体药品集中放在烧杯中。小明为了弄清剩余固体的成份,进行了如下的探究:
(提出猜想)剩余固体是:I.Na2CO3;Ⅱ.NaHCO3;Ⅲ.______。
(进行实验)
操作 | 现象 | 结论 |
①取少量剩余固体于试管中,加入足量水,充分溶解后,滴加几滴酚酞溶液。 | 溶液由无色变红色。 | 剩余固体一定有: ______ 。 |
②取适量剩余固体于试管中,固定在铁架台上,充分加热。 | 白色固体质量减少, 试管内壁有较多水珠出现。 |
(结论分析)
①据上述实验现象,小明认为猜想Ⅲ正确。但有同学认为小明的判断不严谨,因为猜想______也有相同现象。
②同学们讨论后认为,如要确定剩余固体成分,小明只要做实验操作②,并补充操作______,再通过______即可得出结论。
(拓展反思)
有同学提出,碳酸钙和碳酸氢钙能不能互相转化呢?小明认为可以,因课本“资料卡片”中介绍的《石笋和钟乳石的形成》就是“CaCO3→Ca(HCO3)2→CaCO3”的过程。则“CaCO3→Ca(HCO3)2”化学反应方程式为______。