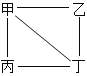
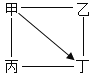
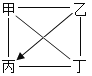
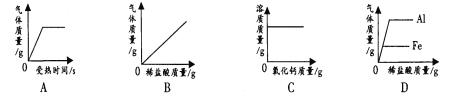
【题目】下表中“—”表示相连的物质间能发生反应,“→”表示这种物质可转化为另一种物质。甲、乙、丙、丁四种物质符合对应“转化关系”的是( )
A | B | C | D | ||
转化关系 |
|
|
|
| |
物质 | 甲 | C | Na2CO3 | Ca(OH)2 | Fe |
乙 | O2 | Ca(OH)2 | HCl | HCl | |
丙 | CuO | MgCl2 | CO2 | CuCl2 | |
丁 | CO2 | H2SO4 | NaOH | NaOH | |
A.AB.BC.CD.D
【题目】某兴趣小组对石灰石样品进行如下实验:取12g样品放人烧杯中,将100g稀盐酸分4次加入,充分反应后(杂质不溶于水,也不与酸反应),测得剩余固体的质量记录如下:
次数 | 1 | 2 | 3 | 4 |
加入稀盐酸的质量/g | 25 | 25 | 25 | 25 |
剩余固体的质量/g | 8 | 4 | 2 | 2 |
请计算:
(1)样品中碳酸钙的质量为
(2)第4次加入稀盐酸后所得溶波中CaCl2的质量分数。(写出计算过程,最终结果保留0. 1%)。
【题目】(1)为测定空气中氧气含量,某小组同学选用40mL的试管作反应容器和量程体积足够大且润滑很好的针筒注射器(如图) ,将足量白磷放入试管后,用橡皮塞塞紧试管,并夹紧弹簧夹。用酒精灯加热白磷,燃烧结束后,待试管冷却后松开弹簧夹,观察现象。
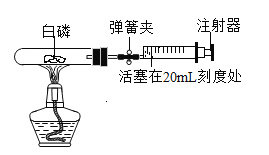
①开始实验前,该小组同学打开弹簧夹,将注射器活塞从20mL刻度处推至15mL处,然后松开活塞,观察到活塞返回至20mL刻度处。该操作的主要目的是_______。
②实验后,可以观察到针筒活塞会从原来的20mL刻度处慢慢向左移到约__处。
a 4mL刻度
b 8mL刻度
c 12mL刻度
d 16mL刻度
③下列实验操作,对实验结果有影响的是______。
a 装置漏气
b 白磷过量
c 燃烧结束后,立即松开弹簧夹,观察现象
(2)小婧同学学习化学后知道,镁在氧气中燃烧会生成白色的氧化镁固体。但她在空气中点燃镁条时,却发现在生成的白色固体中还夹杂着少量的淡黄色固体。
[提出问题]为什么会生成淡黄色固体?
[查阅资料]小婧查阅资料, 记录了下列几种物质的颜色:
物质 | MgO | MgCl2 | Mg3N2 | Mg( NO3)2 | Mg( OH)2 |
颜色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 |
[初步分析]其他同学认为不可能生成上表中的_____,理由是______。
[提出猜想]分析资料,小婧认为淡黄色固体可能是由镁与空气中的___反应生成的。
[实验探究]小婧设计实验证实了自己猜想。
[实验结论]根据小婧的实验结果,写出镁条在空气中燃烧时两个反应的化学方程式:______;___。
[反思与评价]①空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,为什么呢?请给出合理的解释____。
②通过上述实验,你对燃烧有什么新的认识?_____。