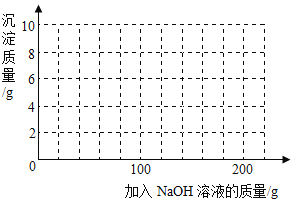
【题目】现有H2SO4与CuSO4的混合溶液,为了分析混合溶液中H2SO4与CuSO4的质量分数,设计如下实验方案:取四份混合溶液各100 g,分别缓慢加入到50 g、100 g、150 g、200 g某NaOH溶液中,测得四组实验数据如下表:
第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | 第Ⅳ组 | |
NaOH溶液的质量/g | 50 | 100 | 150 | 200 |
生成沉淀的质量/g | 0 | 2.45 | 7.35 | 9.8 |
(1)100 g混合溶液与NaOH溶液完全反应生成沉淀的质量为_______g。
(2)混合溶液中CuSO4的溶质质量分数是多少?(写出计算过程)
(3)混合溶液中H2SO4的溶质质量分数为___________。
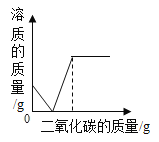
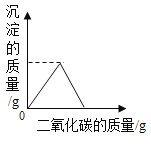
(4)若在100 g混合溶液中不断加入上述NaOH的溶液,请画出加入NaOH溶液的质量与所产生沉淀质量的关系图。(在答题卡的坐标图中作图)
【题目】红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示。同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究。

(提出问题)久置固体的成分是什么?
(查阅资料)铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
(猜想)久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3。
(实验探究1)甲同学的方案:
实验操作 | 实验现象 | 实验结论 |
(1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红 | 固体中一定含有____和Ca(OH)2. |
(2)另取少量固体放于试管中,滴加足量的____ | 固体逐渐消失,有无色气体产生,得到浅绿色溶液 | 固体中一定含有Fe,一定不含Fe2O3 |
(3)将步骤(2)中产生的气体通入到澄清石灰水中 | ____ | 固体中一定含有CaCO3 |
(实验质疑)
(1)乙同学认为甲同学的实验中不能得出一定含Ca(OH)2的结论,理由是_____。
(2)丙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是_____。
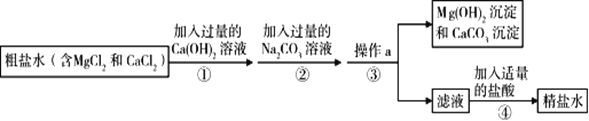
(实验探究2)
乙、丙同学设计如下实验方案继续验证:
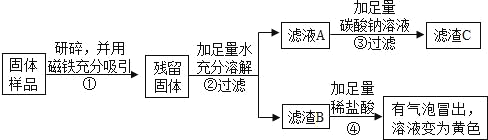
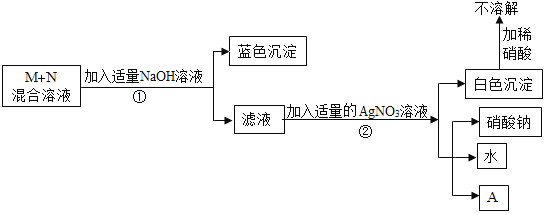
(1)③中反应的化学方程式是_____。
(2)乙、丙同学实验中能得出固体样品中一定还含有_____,仍有一种物质不能确定,该物质是_____。
(3)乙、丙同学又经过实验测得上述残留固体中含钙物质的总质量为1.6g,滤渣B中CaCO3的质量为1.0g,滤渣C的质量为1.0g。
(实验结论)综合上述实验及所给数据,久置固体的成分是_____。