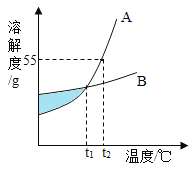
【题目】下表是20℃时部分物质的溶解度数据。
物质 | NaOH | AlCl3 | Al(OH)3 |
溶解度/g | 109 | 69.9 | 0.0015 |
氢氧化铝为两性氢氧化物,能与酸反应也,能与强碱反应,与氢氧化钠反应能生成偏铝酸钠(NaAlO2)和水
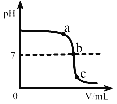
(1)配制溶液。其中配制20℃时100g饱和氯化铝溶液的基本步骤是:称取氯化铝固体—量取水—溶解—装瓶贴标签。
①称取氯化铝固体的质量_____________g。
②量取水加加入烧杯溶解。
③装瓶后贴标签,在标签上填写:_____________。
(2)进行性质探究实验。20℃时,根据数据回答下列问题:
①向氯化铝溶液中通入氢氧化钠直至过量,先生成Al(OH)3,再转化为NaAlO2,可观察到的现象是___________;Al(OH)3与氢氧化钠的反应方程式反应__________。
②将100g饱和氯化铝溶液,与足量的氢氧化钠反应能生成NaAlO2___________g,同时需10%氢氧化钠溶液的质量至少为__________g。(计算结果精确到0.1)
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:
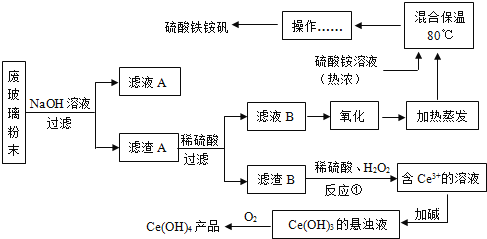
已知:1.SiO2+2NaOH=Na2SiO3+H2O
2.CeO2是一种金属氧化物,化学性质稳定,与稀硫酸不反应。在H2O2存在的条件下,两种物质能反应。
3.硫酸铁铵矾[Fe2(SO4)32(NH4)2SO43H2O]广泛用于水的净化处理.
(1)氧化铈(CeO2)中,铈的化合价为____________,检验硫酸铁铵溶液中含有NH4+的方法是:__________。
(2)为提高①中硫酸的反应效率,可采用的具体措施有_____________。(写一种即可)。
(3)操作应为_____________。
(4)反应①之前先要洗涤滤渣B,其目的是为了除去_____________(填离子符号)。
(5)请补充完整①反应的化学方程式:2CeO2+3H2SO4+H2O2=Ce2(SO4)3+_____+ ____↑。
(6)碲(Te)被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”。实验室模拟提取碲的一个实验是:取某含碲溶液于烧瓶中,加入适量的NaCl,加热到一定温度,持续通入SO2,待反应一段时间,过滤得到粗碲。反应方程式为TeOSO4 +2SO2+3H2O![]() Te↓+ 3H2SO4,为探究获得较高粗碲沉淀率的反应条件,某研究小组在控制NaCl浓度和SO2流量不变的条件下,进行下述对比实验,数据如下:
Te↓+ 3H2SO4,为探究获得较高粗碲沉淀率的反应条件,某研究小组在控制NaCl浓度和SO2流量不变的条件下,进行下述对比实验,数据如下:
实验 | 温度/℃ | 反应时间 | 粗碲沉淀率/% |
a | 65 | 3.0 | 65.0 |
b | 80 | 3.0 | 98.9 |
c | 80 | 2.0 | 98.9 |
d | 90 | 2.0 | 97.0 |
① a和b的结论是______________。
②为了提升设备利用效率和节约能源,可进一步优化反应条件测定粗确沉淀率。若再设计对比实验,选择的反应条件还可以是_________。
A80℃,1.5h B80℃,2.5h C70℃,