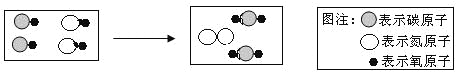
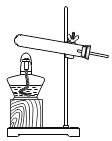
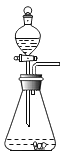
【题目】实验室可用下图所示装置来测定空气中氧气的含量。实验时可观察到:当红磷在集气瓶中燃烧停止后,集气瓶内水面上升大约1/5体积。请你回答:
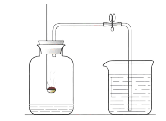
(1)集气瓶内水面上升约1/5体积,由此你得到的结论是:_____________________。
(2)实验中的红磷需要稍微过量,目的是 。
请写出红磷燃烧这一反应的(文字或符号)表达式: 。
(3)通过这个实验,我们还可以认识氮气的一些性质。请将你的分析结果填在下表的横线上。
实 验 现 象 | 分 析 结 果(即氮气的性质) |
①燃烧着的红磷慢慢熄灭了 | |
③集气瓶内的水面上升一定高度后不再上升 |
【题目】Ⅰ.小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行探究:
[提出猜想] 除二氧化锰、氧化铜外,氧化铁也可以作氯酸钾分解的催化剂。
[完成实验] 按下表进测定分解温度(分解温度越低,催化效果越好)。
实验编号 | 实验药品 | 分解温度(℃) |
① | 氯酸钾 | 580 |
② | 氯酸钾、二氧化锰(质量比1︰1) | 350 |
③ | 氯酸钾、氧化铜(质量比1︰1) | 370 |
④ | 氯酸钾、氧化铁(质量比1︰1) | 390 |
(1)由实验_______________与实验④对比,证明猜想合理;
(2)实验所用物质中,催化效果最好的是_______,该反应的化学方程式为________ ;
[反思]
(3)若要证明氧化铁是该反应的催化剂,还要验证它在化学反应前后_______和 ______不变。
Ⅱ.下表是二氧化锰用量与一定质量氯酸钾制取氧气反应速率关系的实验数据:
二氧化锰与氯酸钾的质量比 | 1︰40 | 1︰20 | 1︰10 | 1︰5 | 1︰3 | 1︰2 | 2︰3 | 1︰1 | 2︰1 |
生成1L氧气所需的时间(s) | 124 | 79 | 50 | 54 | 75 | 93 | 106 | 153 | 240 |
(4)据如表可知二氧化锰与氯酸钾的质量比为_______________时,反应速率最快;
(5)通过分析可知,在化学反应中催化剂的用量_______________越多越好。(填“是”或“不是”)
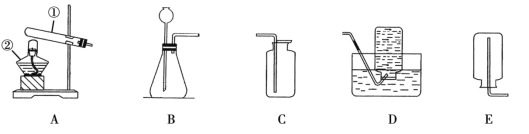
【题目】某校化学兴趣小组就空气中氧气的含量进行实验探究。

(小组讨论)(1)讨论后同学们认为,选择的药品既要能消耗氧气,又不会跟空气中的其他成分反应而且生成物为固体。他们应该选择_______________(填序号),为了充分消耗容器中的氧气,药品的用量应保证_______________;
A 蜡烛 B 红磷 C 硫 D 木炭
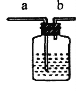
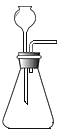
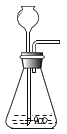
(2)小组同学共同设计如图所示的两套装置,你认为合理的是_________(填序号);为了确保实验的成功,在装药品之前应该_________。
(小组实验)在讨论的基础上,他们分组进行了实验。
(数据分析)实验结束后,整理数据如下:(注:集气瓶容积为100 mL)
组别 | 1 | 2 | 3 | 4 | 5 | 6 |
进入集气瓶中水的体积/mL | 20 | 21 | 18 | 20 | 22 | 19 |
(3)通过对实验结果的交流,大多数同学都验证出氧气约占空气体积的_______________,通过实验还可以推断集气瓶中剩余气体的化学性质是_______________。(写一点即可)