题目内容
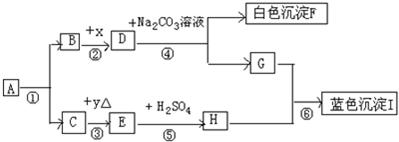
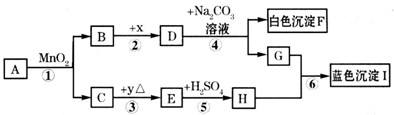
常温下,A.B均为液态,且组成元素相同.生活中,F可用作补钙剂.x是氧化物,y是金属.各物质间的转化关系如图所示(个别产物略去)
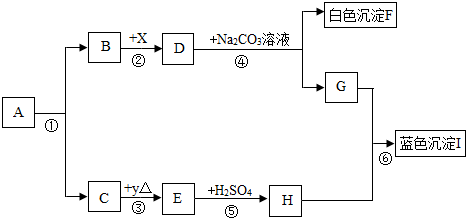
(1)推断:A是______; E是______(写化学式)
(2)反应①常用于______; 由H和石灰加水可配制农业上常用的杀虫剂波尔多液,波尔多液不能用铁制容器盛放的原因是______.
(3)化学变化常伴随颜色改变.上述由物质y→E→H(溶液)的过程中,颜色变化为______色→______色→______色;
(4)写化学方程式:④______⑥______
(5)反应④结束后,从混合物中分离出F的方法是______.鉴别D溶液和G溶液的方法是______.
解:(1)F可用作补钙剂,所以F就是碳酸钙,D就是氢氧化钙,而X又是氧化物,所以X就是氧化钙,B就是水,G就是氢氧化钠,E和硫酸生成H,说明H中有硫酸根离子,氢氧化铜是蓝色沉淀,所以H是硫酸铜,A.B均为液态,且组成元素相同,并且又会生成水的,可以推出A就是双氧水,C就是氧气,y是金属,所以E就是氧化铜,故答案为:H2O2,CuO;
(2)双氧水中加入二氧化锰会分解放出氧气,故答案为:实验室制氧气,
铁在金属活动顺序中排在铜之前,会将铜从硫酸铜中置换出来,故答案为:铁比铜活泼,波尔多液能与铁反应,使铁制容器腐蚀损坏,
(3)加入的铜是紫红色,和氧气反应后生成了氧化铜,氧化铜是黑色的,氧化铜和硫酸反应又生成了硫酸铜,硫酸铜显蓝色,故答案为:紫红色、蓝色、黑色,
(4)氢氧化钙和碳酸钠生成碳酸钙沉淀和氢氧化钠,故答案为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,
氢氧化钠和硫酸铜生成氢氧化铜沉淀和硫酸钠,故答案为:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,
(5)要将可溶物和不溶物进行分离,需要进行过滤,故答案为:过滤,
所有的钠盐都溶于水,钙的碳酸盐不溶于水,故答案为:分别通入二氧化碳,有沉淀生成的是D溶液,无沉淀生成的是C溶液.
分析:(1)D和碳酸钠反应生成白色沉淀F,F可用作补钙剂,所以F就是碳酸钙,D就是氢氧化钙,而X又是氧化物,所以X就是氧化钙,B就是水,G就是氢氧化钠,E和硫酸生成H,说明H中有硫酸根离子,我们所接触的蓝色沉淀,应该是铜的沉淀,所以H是硫酸铜,A.B均为液态,且组成元素相同,并且又会生成水的,可以推出A就是双氧水,C就是氧气,y是金属,所以E就是氧化铜.
(2)根据①的反应原理进行分析,
根据金属活动性顺序和置换反应的原理分析,
(3)根据铜是紫红色,氧化铜是黑色,硫酸铜是蓝色进行分析,
(4)根据反应物、生成物以及复分解反应的原理进行分析,
(5)根据要将沉淀和溶液分离的方法分析,
根据氢氧化钠和氢氧化钙的不同性质进行分析.
点评:本题主要考查了选用正确的试剂对物质进行鉴别的方法,以及混合物的正确的分离方法.
(2)双氧水中加入二氧化锰会分解放出氧气,故答案为:实验室制氧气,
铁在金属活动顺序中排在铜之前,会将铜从硫酸铜中置换出来,故答案为:铁比铜活泼,波尔多液能与铁反应,使铁制容器腐蚀损坏,
(3)加入的铜是紫红色,和氧气反应后生成了氧化铜,氧化铜是黑色的,氧化铜和硫酸反应又生成了硫酸铜,硫酸铜显蓝色,故答案为:紫红色、蓝色、黑色,
(4)氢氧化钙和碳酸钠生成碳酸钙沉淀和氢氧化钠,故答案为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,
氢氧化钠和硫酸铜生成氢氧化铜沉淀和硫酸钠,故答案为:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,
(5)要将可溶物和不溶物进行分离,需要进行过滤,故答案为:过滤,
所有的钠盐都溶于水,钙的碳酸盐不溶于水,故答案为:分别通入二氧化碳,有沉淀生成的是D溶液,无沉淀生成的是C溶液.
分析:(1)D和碳酸钠反应生成白色沉淀F,F可用作补钙剂,所以F就是碳酸钙,D就是氢氧化钙,而X又是氧化物,所以X就是氧化钙,B就是水,G就是氢氧化钠,E和硫酸生成H,说明H中有硫酸根离子,我们所接触的蓝色沉淀,应该是铜的沉淀,所以H是硫酸铜,A.B均为液态,且组成元素相同,并且又会生成水的,可以推出A就是双氧水,C就是氧气,y是金属,所以E就是氧化铜.
(2)根据①的反应原理进行分析,
根据金属活动性顺序和置换反应的原理分析,
(3)根据铜是紫红色,氧化铜是黑色,硫酸铜是蓝色进行分析,
(4)根据反应物、生成物以及复分解反应的原理进行分析,
(5)根据要将沉淀和溶液分离的方法分析,
根据氢氧化钠和氢氧化钙的不同性质进行分析.
点评:本题主要考查了选用正确的试剂对物质进行鉴别的方法,以及混合物的正确的分离方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目