题目内容
“冬天捞碱”所获得的纯碱中含有一定质量的食盐,为测定纯碱的质量分数,称取24.8g样品,加入一定质量的稀盐酸恰好完全反应,得到13.5%的食盐溶液200g,则该纯碱样品中碳酸钠的质量分数为( )A.14.5%
B.42.7%
C.85.5%
D.87.6%
【答案】分析:根据食盐溶液的质量及质量分数,求出氯化钠的质量,根据碳酸钠与稀盐酸的反应,找出固体的增量与碳酸钠的关系式,由固体的增量求出碳酸钠的质量,进而求出碳酸钠的质量分数.
解答:解:氯化钠的总质量是:200g×13.5%=设碳酸钠的质量为x,
Na2CO3+2HCl═2NaCl+CO2↑+H2O 固体增量
106 117 11
x 27g-24.8g
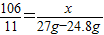
解得:x=21.2g
纯碱样品中碳酸钠的质量分数: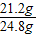 ×100%=85.5%
×100%=85.5%
由以上计算可知,C正确,A、B、D错误.
故选C.
点评:在解题时,根据反应的方程式,找出待求量与已知量之间的关系,利用关系式进行计算,比较简便.
解答:解:氯化钠的总质量是:200g×13.5%=设碳酸钠的质量为x,
Na2CO3+2HCl═2NaCl+CO2↑+H2O 固体增量
106 117 11
x 27g-24.8g
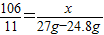
解得:x=21.2g
纯碱样品中碳酸钠的质量分数:
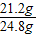 ×100%=85.5%
×100%=85.5%由以上计算可知,C正确,A、B、D错误.
故选C.
点评:在解题时,根据反应的方程式,找出待求量与已知量之间的关系,利用关系式进行计算,比较简便.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
已知氯化钠、纯碱在不同温度时的溶解度:
| 温度/℃ 溶解度/g | 0 | 10 | 20 | 30 | 40 |
| 氯化钠 | 35 | 35.5 | 36 | 36.5 | 37 |
| 纯碱 | 6 | 10 | 18 | 36.5 | 50 |
(1)根据表中所给数据,你能获得哪些信息?
(2)生活在盐碱湖附近的人们“夏天晒盐、冬天捞碱”。你能说出其中的原因吗?
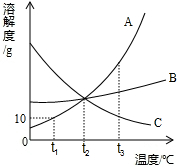
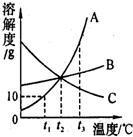 15、小明绘制的三种固体物质的溶解度曲线如图所示:
15、小明绘制的三种固体物质的溶解度曲线如图所示: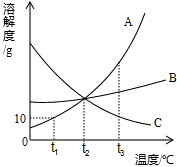 小明绘制的三种固体物质的溶解度曲线如图所示:
小明绘制的三种固体物质的溶解度曲线如图所示: