题目内容
由agKClO3和2gMnO2混合加热一会,得固体7.2g,试求a的取值范围为( )A.a<5.2g
B.5.2g≤a≤8.55g
C.a<8.55g
D.无法确定
【答案】分析:二氧化锰是催化剂,不参与反应;
①如果KClO3完全反应,则剩余固体就是反应生成的KCl和二氧化锰的混合物,所以生成KCl的质量=7.2g-2g=5.2g;然后利用KClO3分解的化学方程式和生成KCl的质量,列出比例式,就可计算出KClO3的质量;
②如果KClO3完全没有反应,则剩余固体就是KClO3和二氧化锰的混合物,剩余固体质量-二氧化锰质量=KClO3的质量;
据此得出a的取值范围.
解答:解:①假设KClO3完全反应,则生成KCl的质量=7.2g-2g=5.2g;
设KClO3的质量为x,
2KClO3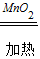 2KCl+3O2↑
2KCl+3O2↑
245 149 96
x 7.2g-2g
∴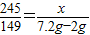
∴x=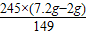 ≈8.55g;
≈8.55g;
②假设KClO3没有反应,则KClO3的质量=7.2g-2g=5.2g;
故a的取值范围为:5.2g≤a≤8.55g.
故选B.
点评:本题主要是运用假设法,利用化学方程式进行计算.解题的关键是分析a的取值范围的两个极端情况.
①如果KClO3完全反应,则剩余固体就是反应生成的KCl和二氧化锰的混合物,所以生成KCl的质量=7.2g-2g=5.2g;然后利用KClO3分解的化学方程式和生成KCl的质量,列出比例式,就可计算出KClO3的质量;
②如果KClO3完全没有反应,则剩余固体就是KClO3和二氧化锰的混合物,剩余固体质量-二氧化锰质量=KClO3的质量;
据此得出a的取值范围.
解答:解:①假设KClO3完全反应,则生成KCl的质量=7.2g-2g=5.2g;
设KClO3的质量为x,
2KClO3
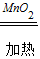 2KCl+3O2↑
2KCl+3O2↑245 149 96
x 7.2g-2g
∴
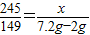
∴x=
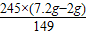 ≈8.55g;
≈8.55g;②假设KClO3没有反应,则KClO3的质量=7.2g-2g=5.2g;
故a的取值范围为:5.2g≤a≤8.55g.
故选B.
点评:本题主要是运用假设法,利用化学方程式进行计算.解题的关键是分析a的取值范围的两个极端情况.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
由agKClO3和2gMnO2混合加热一会,得固体7.2g,试求a的取值范围为( )
| A、a<5.2g | B、5.2g≤a≤8.55g | C、a<8.55g | D、无法确定 |