题目内容
镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取,主要步骤之一为:
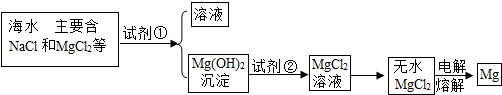
(1)为了使MgCl2转化为Mg(OH)2,试剂①可以选用______;要使MgCl2转化为沉淀,加入试剂①的量应______;验证MgCl2已完全转化Mg(OH)2沉淀的方法是______.
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的操作方法是______;试剂②可以选用______.
(3)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,写出该反应的化学方程式:______.
解:(1)氯化镁转化为氢氧化镁需要加入碱液以提供氢氧根,此处选择过量的氢氧化钠进行反应,目的是让所取海水中的氯化镁全部转化为氢氧化镁沉淀;验证MgCl2已完全转化为Mg(OH)2的方法是取滤液滴入NaOH溶液,若无沉淀产生,则已完全转化.
(2)能分离得到沉淀的操作名称是过滤;
(3)把氢氧化镁转化成氯化镁需加入盐酸进行中和反应.
(4)由题中可知反应产物,再结合化学反应方程式的书写原则书写方程式:MgCl2 Mg+Cl2↑;
Mg+Cl2↑;
故答案为:(1)氢氧化钠溶液;过量;让所取海水中的氯化镁全部转化为氢氧化镁沉淀;取滤液滴入NaOH溶液,若无沉淀产生,则已完全转化;(2)过滤;(3)过量的稀盐酸;(4)MgCl2 Mg+Cl2↑;
Mg+Cl2↑;
分析:(1)氯化镁转化为氢氧化镁需要加入碱液,验证MgCl2已完全转化为Mg(OH)2的方法是取滤液滴入NaOH溶液是否有沉淀生成;
(2)根据分离不溶于水的固体的方法是过滤进行解答;
(3)氢氧化镁转化成氯化镁一般是采用盐酸进行中和反应;
(4)利用题目所给的信息结合书写化学方程式的原则进行书写;
点评:此题是对海水中物质的提纯应用的考查,主要是利用了酸碱盐之间的相关反应,解决了物质的相关转化,是复分解反应发生条件的具体应用.
(2)能分离得到沉淀的操作名称是过滤;
(3)把氢氧化镁转化成氯化镁需加入盐酸进行中和反应.
(4)由题中可知反应产物,再结合化学反应方程式的书写原则书写方程式:MgCl2
 Mg+Cl2↑;
Mg+Cl2↑;故答案为:(1)氢氧化钠溶液;过量;让所取海水中的氯化镁全部转化为氢氧化镁沉淀;取滤液滴入NaOH溶液,若无沉淀产生,则已完全转化;(2)过滤;(3)过量的稀盐酸;(4)MgCl2
 Mg+Cl2↑;
Mg+Cl2↑;分析:(1)氯化镁转化为氢氧化镁需要加入碱液,验证MgCl2已完全转化为Mg(OH)2的方法是取滤液滴入NaOH溶液是否有沉淀生成;
(2)根据分离不溶于水的固体的方法是过滤进行解答;
(3)氢氧化镁转化成氯化镁一般是采用盐酸进行中和反应;
(4)利用题目所给的信息结合书写化学方程式的原则进行书写;
点评:此题是对海水中物质的提纯应用的考查,主要是利用了酸碱盐之间的相关反应,解决了物质的相关转化,是复分解反应发生条件的具体应用.

练习册系列答案
相关题目
在一个密闭容器中放入M、N、P、Q四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,下列说法中,正确的是
| 物质 | M | N | P | Q |
| 反应前质量(g) | 18 | 1 | 32 | 2 |
| 反应后质量(g) | X(未知) | 26 | 12 | 2 |
C.该变化的基本反应类型是分解反应 D.物质Q可能是该反应的________.



 溶解度曲线为我们定量描述物质的溶解性强弱提供了便利.请你根据右图的溶解度曲线回答下列问题:
溶解度曲线为我们定量描述物质的溶解性强弱提供了便利.请你根据右图的溶解度曲线回答下列问题: 化学能改善我们的生活环境,提高生命质量,推动社会的进步.请根据所学的化学知识回答下列问题.
化学能改善我们的生活环境,提高生命质量,推动社会的进步.请根据所学的化学知识回答下列问题. Pb+2H2SO4+______.
Pb+2H2SO4+______.