题目内容
工业上可以用高温煅烧石灰石的方法制取CO2,其反应的方程式为:CaCO3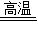 CaO+CO2↑.
CaO+CO2↑.现将50g 含CaCO3质量分数为80%的石灰石样品(杂质不发生化学反应也不含钙),高温煅烧到不产生气体为止.
(1)产生CO2的质量.______
(2)生成氧化钙的质量.______
(3)所得固体中钙元素的质量分数.______.
【答案】分析:(1)根据反应的化学方程式,由参加反应碳酸钙的质量可计算反应放出二氧化碳的质量;
(2)根据反应的化学方程式,由参加反应碳酸钙的质量可计算反应生成氧化钙的质量;
(3)根据化学变化前后元素质量不变,所得固体中钙元素质量即煅烧前碳酸钙中钙元素质量,所得固体中钙元素的质量分数= ×100%,煅烧后固体质量可利用质量守恒定律求得.
×100%,煅烧后固体质量可利用质量守恒定律求得.
解答:解:设产生CO2的质量为x.生成氧化钙的质量为y
CaCO3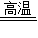 CaO+CO2↑
CaO+CO2↑
100 56 44
50g×80% y x
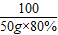 =
=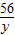 =
=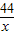
x=17.6g,y=22.4g
所得固体中钙元素的质量分数为: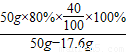 ×100%=49.4%
×100%=49.4%
答:(1)产生CO2的质量为17.6g;(2)生成氧化钙的质量为22.4g;(3)所得固体中钙元素的质量分数为49.4%.
点评:根据反应的化学方程式进行计算时,所使用的质量均为纯净物的质量,含杂质的混合物的质量不能直接代入化学方程式进行计算.
(2)根据反应的化学方程式,由参加反应碳酸钙的质量可计算反应生成氧化钙的质量;
(3)根据化学变化前后元素质量不变,所得固体中钙元素质量即煅烧前碳酸钙中钙元素质量,所得固体中钙元素的质量分数=
 ×100%,煅烧后固体质量可利用质量守恒定律求得.
×100%,煅烧后固体质量可利用质量守恒定律求得.解答:解:设产生CO2的质量为x.生成氧化钙的质量为y
CaCO3
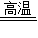 CaO+CO2↑
CaO+CO2↑100 56 44
50g×80% y x
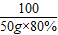 =
=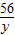 =
=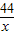
x=17.6g,y=22.4g
所得固体中钙元素的质量分数为:
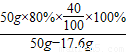 ×100%=49.4%
×100%=49.4%答:(1)产生CO2的质量为17.6g;(2)生成氧化钙的质量为22.4g;(3)所得固体中钙元素的质量分数为49.4%.
点评:根据反应的化学方程式进行计算时,所使用的质量均为纯净物的质量,含杂质的混合物的质量不能直接代入化学方程式进行计算.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
 CaO+CO2↑.
CaO+CO2↑.