题目内容
25、现有三瓶失去标签的无色溶液,分别是稀硫酸、氯化钠溶液、澄清的石灰水.在没有酸碱指示剂的条件下,用一种试剂一次将三种溶液鉴别出来,这种试剂是
碳酸钠溶液,
,写出鉴别时发生反应的化学方程式Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
、Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
.分析:稀硫酸、澄清的石灰水、氯化钠溶液分别是酸碱盐的水溶液,由于没有酸碱指示剂,因此鉴别这三种溶液根据物质的化学性质我们应选择一种合适的盐类物质,在酸碱盐这一块发生的化学变化的现象,无非就是有沉淀或气泡产生等明显现象,而这三种溶液只有稀硫酸在常温下能生成气泡,因此我们可选择碳酸盐,而可溶性的碳酸盐正好可以和氢氧化钙溶液反应生成白色沉淀,因此我们可以选择可溶性碳酸盐.
解答:解:由于为了鉴别这三种溶液,必须要有三种不同的实验现象,而酸碱盐间的反应的现象无非就是有沉淀或气泡生成,而只有稀硫酸在常温下能有气泡生成,故我们应选择碳酸盐,而可溶性的碳酸盐正好可以和氢氧化钙溶液反应生成白色沉淀,因此我们可以选择可溶性碳酸盐.故
答案为:碳酸钠(或碳酸钾)溶液;Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
答案为:碳酸钠(或碳酸钾)溶液;Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
点评:该题考查了通过物质间的反应表现出来的现象的不同来鉴别物质.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
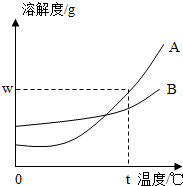 如图所示,A、B两种固体物质的溶解度曲线:
如图所示,A、B两种固体物质的溶解度曲线: