题目内容
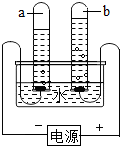
进行电解水实验时,以下说法正确的是( )
分析:A、根据电解水正极产生氧气和氧气的性质解答;
B、根据正极和负极产生的气体的体积比为2:1解答;
C、根据电解水生成氢气和氧气说明水是由氢元素和氧元素组成的解答;
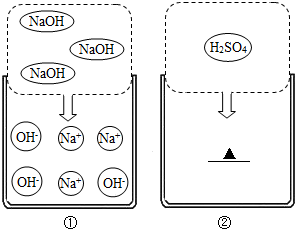
D、根据在水中加入一些稀硫酸或氢氧化钠溶液可以增加水的导电性判断.
B、根据正极和负极产生的气体的体积比为2:1解答;
C、根据电解水生成氢气和氧气说明水是由氢元素和氧元素组成的解答;
D、根据在水中加入一些稀硫酸或氢氧化钠溶液可以增加水的导电性判断.
解答:解:A、电解水正极产生氧气,不具有可燃性不能被点燃,A说法不正确;
B、正极和负极产生的气体体积比是1:2,所以正极产生的气体为10mL,负极就应该是20mL,B说法不正确;
C、正极产生氧气,负极产生氢气,可说明水是由氢元素和氧元素组成的,C说法不正确;
D、电解水前要加入稀硫酸或氢氧化钠溶液增强水的导电性,D说法正确.
故答案选D.
B、正极和负极产生的气体体积比是1:2,所以正极产生的气体为10mL,负极就应该是20mL,B说法不正确;
C、正极产生氧气,负极产生氢气,可说明水是由氢元素和氧元素组成的,C说法不正确;
D、电解水前要加入稀硫酸或氢氧化钠溶液增强水的导电性,D说法正确.
故答案选D.
点评:通过电解水的实验,可以证明水由H、O元素组成,根据电解生成氢气、氧气体积比2:1,要牢记正氧负氢.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
电解水时,常在水中加入少量硫酸以增强水的导电性,若用8%硫酸25g通入直流电进行电解水实验,过一段时间后,硫酸的质量分数为10%,则己电解的水质量为( )
| A、2.5g | B、5g | C、8g | D、10g |