题目内容
小明同学将13.9g含杂质的纯碱样品(碳酸钠与氯化钠的混合物)与90.5g稀盐酸相混合,充分反应,测得反应生成气体的质量(m)与反应时间(t)的数据如表所示:
根据题目要求,回答下列问题:
(1)碳酸钠完全反应后,生成CO2的质量为
(2)请在下面的坐标图中,画出反应是生成气体的质量(m)随时间(t)变化的曲线.
(3)求完全反应后所得溶液中溶质的质量分数.
| 反应时间t/s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
| 气体质量m/g | 0 | 0.88 | 1.76 | 2.64 | 3.52 | 4.4 | 4.4 |
(1)碳酸钠完全反应后,生成CO2的质量为
4.4
4.4
g
(2)请在下面的坐标图中,画出反应是生成气体的质量(m)随时间(t)变化的曲线.
(3)求完全反应后所得溶液中溶质的质量分数.
分析:(1)由于碳酸钠和稀盐酸反应能产生二氧化碳,根据图表数据分析得出生成二氧化碳的质量;
(2)根据图表数据和坐标图中横轴与纵轴的表示,按要求画出反应生成气体的质量(m)随时间(t)变化的曲线;(3)由生成二氧化碳的质量,根据碳酸钠与稀盐酸反应的化学方程式可以计算出样品中碳酸钠的质量和生成氯化钠的质量.进而计算出样品中氯化钠的质量,再加上生成氯化钠的质量就是反应后溶液中的溶质质量,最后结合所得溶液的质量根据溶质质量分数的计算公式可以计算出反应后的溶液中溶质的质量分数.
(2)根据图表数据和坐标图中横轴与纵轴的表示,按要求画出反应生成气体的质量(m)随时间(t)变化的曲线;(3)由生成二氧化碳的质量,根据碳酸钠与稀盐酸反应的化学方程式可以计算出样品中碳酸钠的质量和生成氯化钠的质量.进而计算出样品中氯化钠的质量,再加上生成氯化钠的质量就是反应后溶液中的溶质质量,最后结合所得溶液的质量根据溶质质量分数的计算公式可以计算出反应后的溶液中溶质的质量分数.
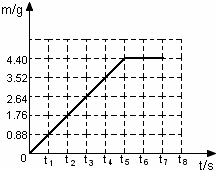
解答:解:(1)由图表数据可知,碳酸钠完全反应后,生成CO2的质量为:4.4g;
(2)根据图表数据,画出反应生成气体的质量(m)随时间(t)变化的曲线:
(3)设样品中碳酸钠的质量为x,反应生成NaCl的质量为y
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 117 44
x y 4.4g
解之得:x=10.6g y=11.7g
∴样品中氯化钠的质量为13.9g-10.6g=3.3g
反应后溶液中溶质的质量=11.7g+3.3g=15g
反应后溶液的质量=13.9g+90.5g-4.4g=100g
∴完全反应后所得溶液中溶质的质量分数为
×100%=15%
故答为:(1)4.4;(2)见上表;(3):完全反应后所得溶液中溶质的质量分数为15%.
(2)根据图表数据,画出反应生成气体的质量(m)随时间(t)变化的曲线:

(3)设样品中碳酸钠的质量为x,反应生成NaCl的质量为y
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 117 44
x y 4.4g
解之得:x=10.6g y=11.7g
∴样品中氯化钠的质量为13.9g-10.6g=3.3g
反应后溶液中溶质的质量=11.7g+3.3g=15g
反应后溶液的质量=13.9g+90.5g-4.4g=100g
∴完全反应后所得溶液中溶质的质量分数为
| 15g |
| 100g |
故答为:(1)4.4;(2)见上表;(3):完全反应后所得溶液中溶质的质量分数为15%.
点评:本题主要考查有关样品混合物的化学方程式的计算和有关溶质质量分数的计算,能锻炼学生的慎密思维及解题能力,难度较大.明确数据的分析是解答本题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
小明同学将13.9g含杂质的纯碱样品(碳酸钠与氯化钠的混合物)与90.5g稀盐酸相混合,充分反应,测得反应生成气体的质量(m)与反应时间(t)的数据如下表所示:
根据题目要求,回答下列问题:
(1)碳酸钠完全反应后,生成CO2的质量为 g
(2)请在下面的坐标图中,画出反应时生成气体的质量(m)随时间(t)变化的曲线.
(3)求完全反应后所得溶液中溶质的质量分数.(Na2CO3+2HCl=2NaCl+CO2↑+H2O).
| 反应时间t/s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
| 气体质量m/g | 0 | 0.88 | 1.76 | 2.64 | 3.52 | 4.4 | 4.4 |
(1)碳酸钠完全反应后,生成CO2的质量为
(2)请在下面的坐标图中,画出反应时生成气体的质量(m)随时间(t)变化的曲线.

(3)求完全反应后所得溶液中溶质的质量分数.(Na2CO3+2HCl=2NaCl+CO2↑+H2O).
小明同学将13.9g含杂质的的纯碱样品(碳酸钠与氯化钠的混合物)与90.5g稀盐酸相混合,充分反应,测得反应生成气体的质量(m)与反应时间(t)的数据如下表所示:
| 反应时间t/s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
| 气体质量m/g | 0 | 0.88 | 1.76 | 2.64 | 3.52 | 4.4 | 4.4 |
根据题目要求,回答下列问题:
(1)碳酸钠完全反应后,生成CO2的质量为 g
(2)请在下面的坐标图中,画出反应是生成气体的质量(m)随时间(t)变化的曲线。
(3)求完全反应后所得溶液中溶质的质量分数。(Na2CO3+2HCl=2NaCl+CO2↑+H2O)。