题目内容
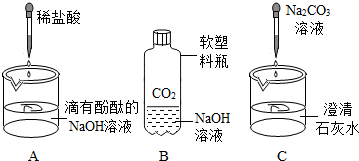
26、化学课上,同学们利用下列实验探究碱的化学性质:
(1)甲实验中加入指示剂酚酞的目的是
(2)乙实验中反应的化学方程式为
(3)丙实验观察到的现象是
(4)实验结束后,同学们将废液倒入同一只废液缸中,发现废液浑浊并显红色,小刚脱口而出“废液中含有氢氧化钠”,小刚的说法正确吗?说明理由
于是同学们对废液的成分展开讨论和探究:
猜想与假设:通过分析上述实验,同学们猜想:废液中除酚酞外还一定含有
查阅资料:CaCl2+Na2CO3→CaCO3↓+2NaCl
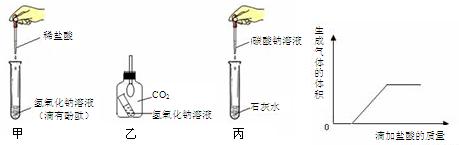
实验验证:同学们取一定量的废液过滤后,向滤液中逐滴加入稀盐酸,根据反应现象绘制了如图所示的示意图.
结论解释:分析图象数据得出可能存在的物质中,含有
(1)甲实验中加入指示剂酚酞的目的是
证明盐酸与氢氧化钠溶液发生反应
;(2)乙实验中反应的化学方程式为
2NaOH+CO2═Na2CO3+H2O
;(3)丙实验观察到的现象是
产生白色沉淀(或溶液变浑浊)
;(4)实验结束后,同学们将废液倒入同一只废液缸中,发现废液浑浊并显红色,小刚脱口而出“废液中含有氢氧化钠”,小刚的说法正确吗?说明理由
不正确.因为碳酸钠溶液或石灰水呈碱性
.于是同学们对废液的成分展开讨论和探究:
猜想与假设:通过分析上述实验,同学们猜想:废液中除酚酞外还一定含有
NaCl、CaCO3
,可能含有Ca(OH)2、NaOH、CaCl2、Na2CO3
中的一种或几种.查阅资料:CaCl2+Na2CO3→CaCO3↓+2NaCl
实验验证:同学们取一定量的废液过滤后,向滤液中逐滴加入稀盐酸,根据反应现象绘制了如图所示的示意图.
结论解释:分析图象数据得出可能存在的物质中,含有
NaOH、Na2CO3
;没有Ca(OH)2、CaCl2
,理由是如图可知,在滤液中滴加盐酸开始没有气泡,一段时间后有气泡产生,则说明滤液中一定含有NaOH和Na2CO3,由于
Na2CO3的存在一定没有Ca(OH)2、CaCl2存在.
.Na2CO3的存在一定没有Ca(OH)2、CaCl2存在.

分析:(1)酸碱指示剂跟酸和碱作用显示不同的颜色,无色酚酞遇酸不变色,遇碱变红色;
(2)NaOH溶液吸CO2收生成Na2CO3和H2O;
(3)碳酸钠与石灰水反应生成碳酸钙沉淀(CaCO3).
(4)根据试验的各种现象逐一确定各种物质.有沉淀就是CaCO3NaCl是一定的生成物.
(2)NaOH溶液吸CO2收生成Na2CO3和H2O;
(3)碳酸钠与石灰水反应生成碳酸钙沉淀(CaCO3).
(4)根据试验的各种现象逐一确定各种物质.有沉淀就是CaCO3NaCl是一定的生成物.
解答:解:
(1)滴有酚酞的氢氧化钠溶液呈红色,滴入盐酸红色变浅直至消失,证明盐酸与氢氧化钠反应;
(2)NaOH溶液吸收CO2生成Na2CO3和H2O,化学反应式为:2NaOH+CO2═Na2CO3+H2O;
(3)碳酸钠与石灰水反应生成碳酸钙沉淀(CaCO3).故C试验的现象是:澄清石灰水变浑浊;
(4)Ca(OH)2、Na2CO3溶液也可使酚酞试液变红;
猜想与假设:
①废液浑浊是因为碳酸钠溶液与石灰水反应生成了碳酸钙沉淀;稀盐酸与氢氧化钠溶液反应生成了氯化钠,氯化钠不再于其他物质反应.故一定含有:CaCO3、NaCl;
②甲实验生成NaCl和H2O,乙实验生成Na2CO3和H2O,丙实验生成CaCO3和NaOH,且反应物的用量不同,废液显红色说明废液中没有盐酸,故可能有Ca(OH) 2、NaOH、CaCl2、Na2CO3中的一种或几种;
【结论解释】
①通过图形可以看出滴加盐酸后,有气体生成,说明一定有Na2CO3;②Na2CO3和Ca(OH) 2、CaCl2均生成碳酸钙沉淀,说明一定没有Ca(OH)2、CaCl2;
故答案为:
(1)证明盐酸与氢氧化钠溶液发生反应
(2)2NaOH+CO2→Na2CO3+H2O
(3)产生白色沉淀(或溶液变浑浊)
(4)不正确.因为碳酸钠溶液或石灰水呈碱性
【猜想与假设】NaCl、CaCO3;
Ca(OH) 2、NaOH、CaCl2、Na2CO3
【结论解释】NaOH、Na2CO3;Ca(OH)2、CaCl2
如图可知,在滤液中滴加盐酸开始没有气泡,一段时间后有气泡产生,则说明滤液中一定含有NaOH和Na2CO3,由于Na2CO3的存在一定没有Ca(OH) 2、CaCl2存在.
(1)滴有酚酞的氢氧化钠溶液呈红色,滴入盐酸红色变浅直至消失,证明盐酸与氢氧化钠反应;
(2)NaOH溶液吸收CO2生成Na2CO3和H2O,化学反应式为:2NaOH+CO2═Na2CO3+H2O;
(3)碳酸钠与石灰水反应生成碳酸钙沉淀(CaCO3).故C试验的现象是:澄清石灰水变浑浊;
(4)Ca(OH)2、Na2CO3溶液也可使酚酞试液变红;
猜想与假设:
①废液浑浊是因为碳酸钠溶液与石灰水反应生成了碳酸钙沉淀;稀盐酸与氢氧化钠溶液反应生成了氯化钠,氯化钠不再于其他物质反应.故一定含有:CaCO3、NaCl;
②甲实验生成NaCl和H2O,乙实验生成Na2CO3和H2O,丙实验生成CaCO3和NaOH,且反应物的用量不同,废液显红色说明废液中没有盐酸,故可能有Ca(OH) 2、NaOH、CaCl2、Na2CO3中的一种或几种;
【结论解释】
①通过图形可以看出滴加盐酸后,有气体生成,说明一定有Na2CO3;②Na2CO3和Ca(OH) 2、CaCl2均生成碳酸钙沉淀,说明一定没有Ca(OH)2、CaCl2;
故答案为:
(1)证明盐酸与氢氧化钠溶液发生反应
(2)2NaOH+CO2→Na2CO3+H2O
(3)产生白色沉淀(或溶液变浑浊)
(4)不正确.因为碳酸钠溶液或石灰水呈碱性
【猜想与假设】NaCl、CaCO3;
Ca(OH) 2、NaOH、CaCl2、Na2CO3
【结论解释】NaOH、Na2CO3;Ca(OH)2、CaCl2
如图可知,在滤液中滴加盐酸开始没有气泡,一段时间后有气泡产生,则说明滤液中一定含有NaOH和Na2CO3,由于Na2CO3的存在一定没有Ca(OH) 2、CaCl2存在.
点评:本题利用各种试验现象推断物质的成分.考查碱在化学反应中的性质.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目