题目内容
A、
| ||
B、
| ||
C、
| ||
D、
|
| 稀释前溶液中的溶质质量 |
| 稀释前溶液质量+稀释所加入水的质量 |
假设原氯化钠溶液的质量分数为a,
经过第一次洗涤后溶液的质量分数=
| 0.5g×a |
| 0.5g+20g |
| a |
| 41 |
再进行第二次洗涤,洗涤后溶液的质量分数=
0.5g×
| ||
| 0.5g+20g |
| a |
| 1681 |
经2次洗涤后烧杯内残留的NaCl溶液中溶质的质量分数约为原NaCl溶液的
| 1 |
| 1681 |
故选D.

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案(6分)水和溶液在生命活动和生产、生活中起着十分重要的作用。
(1)净水器中经常使用活性炭,主要利用活性炭的_______性。
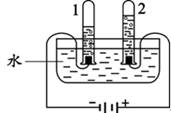
(2)根据图中实验只生成了氢气和氧气,确定水是由氢元素和氧元素组成的,得到此结论的依据是________。写出此实验中发生反应的化学方程式________。
(3)烧杯中盛有一定质量、温度为80℃、溶质为M的溶液,将其置于室温环境中,测定不同温度时析出固体M的质量。测定结果记录如下表。
|
溶液的温度/℃ |
75 |
65 |
50 |
35 |
20 |
|
析出固体M的质量/g |
0 |
0 |
2.0 |
4.5 |
8.4 |
若不考虑水蒸发对实验的影响,请回答下列问题。
① 65℃时,该溶液是否为饱和溶液? (填“是”、“否”或“无法判断”);
② 将t℃时接近饱和的M溶液变成饱和溶液,下列方法中一定能达到目的的是 (填字母序号);
A. 升温 B. 降温 C. 加溶质M
D. 加水 E. 加另一种固体N F. 恒温蒸发水
G. 与t℃时M的饱和溶液混合
③ 20℃时,用固体粉末M和水配制100g溶质质量分数为5%的M溶液,必须用到的仪器有:托盘天平(带砝码)、烧杯、 。
(4分)烧杯中盛有一定质量、温度为80℃、溶质为M的溶液,将其置于室温环境中,测定不同温度时析出固体M的质量。测定结果记录如下表。
|
溶液的温度/℃ |
75 |
65 |
50 |
35 |
20 |
|
析出固体M的质量/g |
0 |
0 |
2.0 |
4.5 |
8.4 |
若不考虑水蒸发对实验的影响,请回答下列问题。
(1)65℃时,该溶液是否为饱和溶液?______(填“是”、“否”或“无法判断”);
(2)将40℃时接近饱和的M溶液变成饱和溶液,下列方法中一定能达到目的的有 _ (填序号)。
①升温 ②降温 ③加溶质M④加水 ⑤加另一种固体N⑥恒温蒸发水 ⑦与40℃时M的饱和溶液混合
(3)20℃时,用固体粉末M和水配制100g溶质质量分数为5%的M溶液,必须用到的仪器有:托盘天平(带砝码盒)、烧杯、______。
 (1)如图所示,氯化铵和硝酸钾溶解度曲线.
(1)如图所示,氯化铵和硝酸钾溶解度曲线.
①60℃时,硝酸钾的溶解度______氯化铵的溶解度(填“>”、“<”、或“=”).
②______℃时,氯化铵饱和溶液与硝酸钾饱和溶液的溶质质量分数相等.
③60℃时,100g水中加入120g硝酸钾,充分搅拌,得到的硝酸钾溶液的质量为______g.
(2)烧杯中盛有一定质量、温度为80℃、溶质为M的溶液,将其置于室温环境中,测定不同温度时析出固体M的质量.测定结果记录如下表.
| 溶液的温度/℃ | 75 | 65 | 50 | 35 | 20 |
| 析出固体M的质量/g | 0 | 0 | 2.0 | 4.5 | 8.4 |
①65℃时,该溶液是否为饱和溶液?______(填“是”、“否”或“无法判断”);
②将40℃时接近饱和的M溶液变成饱和溶液,下列方法中一定能达到目的有______(填序号,此题为2分,错答不给分,漏答给1分)).
a.升温 b.降温 c.加溶质M d.加水 e.加另一种固体N
f.恒温蒸发水 g.与40℃时M的饱和溶液混合.
 (1)如图所示,氯化铵和硝酸钾溶解度曲线.
(1)如图所示,氯化铵和硝酸钾溶解度曲线.①60℃时,硝酸钾的溶解度 氯化铵的溶解度(填“>”、“<”、或“=”).
② ℃时,氯化铵饱和溶液与硝酸钾饱和溶液的溶质质量分数相等.
③60℃时,100g水中加入120g硝酸钾,充分搅拌,得到的硝酸钾溶液的质量为 g.
(2)烧杯中盛有一定质量、温度为80℃、溶质为M的溶液,将其置于室温环境中,测定不同温度时析出固体M的质量.测定结果记录如下表.
| 溶液的温度/℃ | 75 | 65 | 50 | 35 | 20 |
| 析出固体M的质量/g | 2.0 | 4.5 | 8.4 |
①65℃时,该溶液是否为饱和溶液? (填“是”、“否”或“无法判断”);
②将40℃时接近饱和的M溶液变成饱和溶液,下列方法中一定能达到目的有 (填序号,此题为2分,错答不给分,漏答给1分)).
a.升温 b.降温 c.加溶质M d.加水 e.加另一种固体N
f.恒温蒸发水 g.与40℃时M的饱和溶液混合.
 (2013?密云县一模)(1)如图所示,氯化铵和硝酸钾溶解度曲线.
(2013?密云县一模)(1)如图所示,氯化铵和硝酸钾溶解度曲线.