题目内容
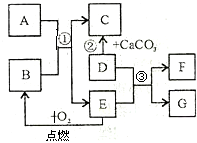 初中化学常见物质A-G有如右图所示的转化关系(部分反应条件及物质已略去),已知A、C所含元素相同且均为气体,反应②为实验室制取气体C的方法;E元素在地壳中含量居金属元素的第二位;F是最轻的气体.请回答下列问题:
初中化学常见物质A-G有如右图所示的转化关系(部分反应条件及物质已略去),已知A、C所含元素相同且均为气体,反应②为实验室制取气体C的方法;E元素在地壳中含量居金属元素的第二位;F是最轻的气体.请回答下列问题:
(1)反应②的反应类型为______.
(2)写出物质的名称:C为______;D为______.
(3)写出有关反应的化学方程式:
E在氧气中燃烧______;
反应①______;
反应③______.
(4)F的一种用途是______.
(5)小强同学在做中和反应实验时,向盛有40g 10%的氢氧化钠溶液的烧杯中逐滴加入稀盐酸,当恰好完全反应时,共滴加了36.5g稀盐酸.
①用氢氧化钠固体配制40g 10%的氢氧化钠溶液需要水______mL.(ρ水=1.0g/mL)
②该中和反应的反应原理是______.
③所加稀盐酸的溶质质量分数是______,反应后所得溶液中溶质的质量是______.
解:E元素在地壳中含量居金属元素的第二位,可知E为铁,铁在氧气中燃烧生成四氧化三铁B;F是最轻的气体,铁E和D反应生成F氢气,D为酸,又D与碳酸钙反应生成气体C,可推知D为盐酸,进而可知G为氯化亚铁;A、C所含元素相同且均为气体,C是二氧化碳,则A是具有还原性的一氧化碳;
(1)反应②为实验室制取二氧化碳的反应,其化学方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O,故为复分解反应;
故填:复分解反应;
(2)C为二氧化碳;D为盐酸;
故填:二氧化碳;盐酸;
(3)E为铁,铁在氧气中燃烧生成四氧化三铁B,反应的方程式为:3Fe+2O2 Fe3O4;
Fe3O4;
反应①是一氧化碳还原四氧化三铁产生铁和二氧化碳,反应的方程式为:4CO+Fe3O4 3Fe+4CO2;
3Fe+4CO2;
反应③是铁和稀盐酸反应产生氯化亚铁和氢气,反应的方程式为:Fe+2HCl=FeCl2+H2↑;
故填:3Fe+2O2 Fe3O4 ;4CO+Fe3O4
Fe3O4 ;4CO+Fe3O4 3Fe+4CO2;Fe+2HCl=FeCl2+H2↑;
3Fe+4CO2;Fe+2HCl=FeCl2+H2↑;
(4)F手氢气,因为具有可燃性可以用作燃料或具有还原性用作冶炼金属等;
故填:用作燃料或冶炼金属等;
(5)①需要水的体积为:40g×(1-10%)÷1.0g/mL=36mL;
②该中和反应的反应原理是:NaOH+HCl=NaCl+H2O;
③设稀盐酸中溶质的质量分数为x,反应生成的NaCl的质量为y
NaOH+HCl=NaCl+H2O
40 36.5 58.5
40g×10% 36.5g×x y
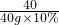 =
=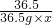 x=10%
x=10%
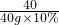 =
= y=5.85g
y=5.85g
答:所加稀盐酸的溶质质量分数为10%;反应后所得溶液中溶质的质量为5.85g.
故填:①36;②NaOH+HCl=NaCl+H2O;③10%;5.85g.
分析:本题为框图式推断题,解题关键是找准突破口,本题突破口是E元素在地壳中含量居金属元素的第二位,可知E为铁,铁在氧气中燃烧生成四氧化三铁B;F是最轻的气体,铁E和D反应生成F氢气,D为酸,又D与碳酸钙反应生成气体C,可推知D为盐酸,进而可知G为氯化亚铁;A、C所含元素相同且均为气体,C是二氧化碳,则A是具有还原性的一氧化碳;带入验证即可,根据推断出的化学式,完成相关的问题;
由氢氧化钠溶液的质量和溶质质量分数可以计算出溶液中溶剂的质量;由氢氧化钠溶液的质量和溶质质量分数、稀盐酸的质量,根据化学方程式可以计算出稀盐酸的溶质质量分数和生成氯化钠的质量.
点评:本题为框图式推断题,解题的关键是在审题的基础上找准解题的突破口,经过分析、归纳、推理、得出正确的答案;
在根据化学方程式计算时注意步骤的书写要规范,难度不大.
(1)反应②为实验室制取二氧化碳的反应,其化学方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O,故为复分解反应;
故填:复分解反应;
(2)C为二氧化碳;D为盐酸;
故填:二氧化碳;盐酸;
(3)E为铁,铁在氧气中燃烧生成四氧化三铁B,反应的方程式为:3Fe+2O2
 Fe3O4;
Fe3O4;反应①是一氧化碳还原四氧化三铁产生铁和二氧化碳,反应的方程式为:4CO+Fe3O4
 3Fe+4CO2;
3Fe+4CO2;反应③是铁和稀盐酸反应产生氯化亚铁和氢气,反应的方程式为:Fe+2HCl=FeCl2+H2↑;
故填:3Fe+2O2
 Fe3O4 ;4CO+Fe3O4
Fe3O4 ;4CO+Fe3O4 3Fe+4CO2;Fe+2HCl=FeCl2+H2↑;
3Fe+4CO2;Fe+2HCl=FeCl2+H2↑;(4)F手氢气,因为具有可燃性可以用作燃料或具有还原性用作冶炼金属等;
故填:用作燃料或冶炼金属等;
(5)①需要水的体积为:40g×(1-10%)÷1.0g/mL=36mL;
②该中和反应的反应原理是:NaOH+HCl=NaCl+H2O;
③设稀盐酸中溶质的质量分数为x,反应生成的NaCl的质量为y
NaOH+HCl=NaCl+H2O
40 36.5 58.5
40g×10% 36.5g×x y
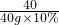 =
=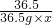 x=10%
x=10%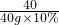 =
= y=5.85g
y=5.85g答:所加稀盐酸的溶质质量分数为10%;反应后所得溶液中溶质的质量为5.85g.
故填:①36;②NaOH+HCl=NaCl+H2O;③10%;5.85g.
分析:本题为框图式推断题,解题关键是找准突破口,本题突破口是E元素在地壳中含量居金属元素的第二位,可知E为铁,铁在氧气中燃烧生成四氧化三铁B;F是最轻的气体,铁E和D反应生成F氢气,D为酸,又D与碳酸钙反应生成气体C,可推知D为盐酸,进而可知G为氯化亚铁;A、C所含元素相同且均为气体,C是二氧化碳,则A是具有还原性的一氧化碳;带入验证即可,根据推断出的化学式,完成相关的问题;
由氢氧化钠溶液的质量和溶质质量分数可以计算出溶液中溶剂的质量;由氢氧化钠溶液的质量和溶质质量分数、稀盐酸的质量,根据化学方程式可以计算出稀盐酸的溶质质量分数和生成氯化钠的质量.
点评:本题为框图式推断题,解题的关键是在审题的基础上找准解题的突破口,经过分析、归纳、推理、得出正确的答案;
在根据化学方程式计算时注意步骤的书写要规范,难度不大.

练习册系列答案
相关题目
 (2013?密云县二模)A、B、D、E是初中化学常见物质,分别由C、H、O、S、Na、Ca、Fe等七种元素中的一种或几种组成,四种物质的转化关系如下图所示,其中D为一种生命活动不可或缺的无色液体.
(2013?密云县二模)A、B、D、E是初中化学常见物质,分别由C、H、O、S、Na、Ca、Fe等七种元素中的一种或几种组成,四种物质的转化关系如下图所示,其中D为一种生命活动不可或缺的无色液体.
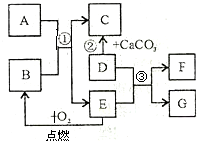 初中化学常见物质A-G有如右图所示的转化关系(部分反应条件及物质已略去),已知A、C所含元素相同且均为气体,反应②为实验室制取气体C的方法;E元素在地壳中含量居金属元素的第二位;F是最轻的气体.请回答下列问题:
初中化学常见物质A-G有如右图所示的转化关系(部分反应条件及物质已略去),已知A、C所含元素相同且均为气体,反应②为实验室制取气体C的方法;E元素在地壳中含量居金属元素的第二位;F是最轻的气体.请回答下列问题: