题目内容
23、小亮用图1装置在做“盐酸中和氢氧化钠溶液”的实验时,
滴加盐酸前忘了加入指示剂,导致无法判断该中和反应是否恰好反应完全.于是他对所得溶液的酸碱性进行了探究.

[探究目的]探究所得溶液的酸碱性
[提出猜想]所得溶液可能呈碱性,也可能呈酸性,还可能呈中性.
[实验验证]

[分析与思考]
(1)若溶液呈碱性,则溶液中使其呈碱性的离子是
(2)若无色酚酞试液不变色,为了进一步确定溶液的酸碱性,小亮提出了以下方案:
方案一:取样,加入碳酸钠溶液,若观察到
方案二:取样,加入金属锌,若有气泡产生,则所取溶液呈酸性,该反应的化学方程式为
[反思与评价]
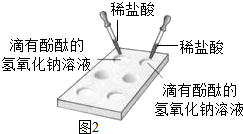
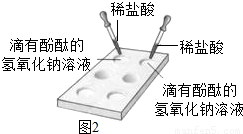
(1)小建认为若要判断“盐酸和氢氧化钠溶液是否反应”时,只需要选择(图2)的方法即可,请你分析小建选择(图2)的方法的原因是:

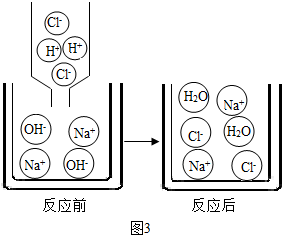
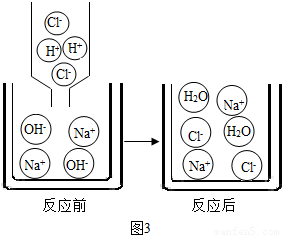
(2)小娜查阅了相关资料得知,盐酸与氢氧化钠反应的微观示意图可以用(图3)来表示,试从微观粒子的变化角度分析中和反应的实质是

滴加盐酸前忘了加入指示剂,导致无法判断该中和反应是否恰好反应完全.于是他对所得溶液的酸碱性进行了探究.

[探究目的]探究所得溶液的酸碱性
[提出猜想]所得溶液可能呈碱性,也可能呈酸性,还可能呈中性.
[实验验证]

[分析与思考]
(1)若溶液呈碱性,则溶液中使其呈碱性的离子是
OH-
(填写粒子符号);(2)若无色酚酞试液不变色,为了进一步确定溶液的酸碱性,小亮提出了以下方案:
方案一:取样,加入碳酸钠溶液,若观察到
有气泡产生
,则所取溶液呈酸性;若无明显现象,则呈中性.方案二:取样,加入金属锌,若有气泡产生,则所取溶液呈酸性,该反应的化学方程式为
Zn+2HCl=ZnCl2+H2↑
;若无明显现象,则呈中性.[反思与评价]
(1)小建认为若要判断“盐酸和氢氧化钠溶液是否反应”时,只需要选择(图2)的方法即可,请你分析小建选择(图2)的方法的原因是:
碱会使酚酞变红色,而酸和盐不会使酚酞变色,在氢氧化钠中滴入酚酞,溶液变红,加入盐酸后,发生中和反应生成盐和水,红色褪去
.
(2)小娜查阅了相关资料得知,盐酸与氢氧化钠反应的微观示意图可以用(图3)来表示,试从微观粒子的变化角度分析中和反应的实质是
OH-+H+=H2O
.
分析:(1)无色酚酞遇碱变红色,实际上是碱中的氢氧根离子使石蕊变色,而碱中具有的相同的离子是氢氧根离子,
(2)碱会使酚酞变红色,而盐酸和氯化钠不会使酚酞变色,
[反思与评价]中和反应的实质就是氢氧根离子和氢离子生成水的过程,
(2)碱会使酚酞变红色,而盐酸和氯化钠不会使酚酞变色,
[反思与评价]中和反应的实质就是氢氧根离子和氢离子生成水的过程,
解答:解:[实验验证]因显碱性,变红色;
(1)若溶液呈碱性,则溶液中使其呈碱性的离子是OH-;
(2)方案一:取样,加入碳酸钠溶液,若观察到有气泡产生;方案二:取样,加入金属锌,若有气泡产生,则所取溶液呈酸性,该反应的化学方程式为Zn+2HCl=ZnCl2+H2↑;
[反思与评价]
(1)小建认为若要判断“盐酸和氢氧化钠溶液是否反应”时,只需要选择(图2)的方法即可,请你分析小建选择(图2)的方法的原因是:碱会使酚酞变红色,而酸和盐不会使酚酞变色,在氢氧化钠中滴入酚酞,溶液变红,加入盐酸后,发生中和反应生成盐和水,红色褪去;
(2)氢氧化钠在水中会电离出氢氧根离子和钠离子,盐酸在水中会电离出氢离子和氯离子,水不会进行电离,氯化钠电离出钠离子和氯离子,故答案为:OH-+H+=H2O.
故答案为:[实验验证]红;(1)OH-;(2)有气泡产生; Zn+2HCl=ZnCl2+H2↑;
[反思与评价](1)碱会使酚酞变红色,而酸和盐不会使酚酞变色,在氢氧化钠中滴入酚酞,溶液变红,加入盐酸后,发生中和反应生成盐和水,红色褪去;(2)OH-+H+=H2O
(1)若溶液呈碱性,则溶液中使其呈碱性的离子是OH-;
(2)方案一:取样,加入碳酸钠溶液,若观察到有气泡产生;方案二:取样,加入金属锌,若有气泡产生,则所取溶液呈酸性,该反应的化学方程式为Zn+2HCl=ZnCl2+H2↑;
[反思与评价]
(1)小建认为若要判断“盐酸和氢氧化钠溶液是否反应”时,只需要选择(图2)的方法即可,请你分析小建选择(图2)的方法的原因是:碱会使酚酞变红色,而酸和盐不会使酚酞变色,在氢氧化钠中滴入酚酞,溶液变红,加入盐酸后,发生中和反应生成盐和水,红色褪去;
(2)氢氧化钠在水中会电离出氢氧根离子和钠离子,盐酸在水中会电离出氢离子和氯离子,水不会进行电离,氯化钠电离出钠离子和氯离子,故答案为:OH-+H+=H2O.
故答案为:[实验验证]红;(1)OH-;(2)有气泡产生; Zn+2HCl=ZnCl2+H2↑;
[反思与评价](1)碱会使酚酞变红色,而酸和盐不会使酚酞变色,在氢氧化钠中滴入酚酞,溶液变红,加入盐酸后,发生中和反应生成盐和水,红色褪去;(2)OH-+H+=H2O
点评:本题主要考查了中和反应的实质和酸碱指示剂遇酸碱后的不同显色.

练习册系列答案
相关题目
(11分)某研究性学习小组对双氧水开展如下研究。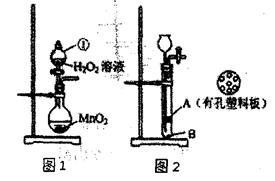
(1)图1装置中仪器①的名称为 。
(2)小林同学将MnO2与水泥按一定比例混合,制作成小块状固体,加入图2装置中制氧气,以方便实验结束回收二氧化锰。其中块状固体应放置在 处(填“A”或“B”),二氧化锰的作用是 ,该装置中反应的文字表达式是 。利用该装置反应一段时间后,需停止反应,其操作是 ,原因是 。
(3)小亮发现:收集的氧气占集气瓶容积的60%(空气占40%)时,能使带火星的木条复燃。那么,使带火星的木条复燃的氧气浓度的最低值是多少呢?小亮对此展开探究。
第一组实验:取5只集气瓶,编号为①、②、③、④、⑤,分别装入其总容积10%、20%、30%、40%、50%的水。用排水法收集氧气,恰好把5只集气瓶中的水排去。将带火星的术条依次插入①~⑤号瓶中,记录实验现象。
小亮在前一组实验的基础上又做了第二组和第三组实验。三组实验的数据和现象见下表。
| | 第一组 | 第二组 | 第三组 | ||||||||
| 集气瓶编号 | ① | ② | ③ | ④ | ⑤ | ① | ② | ③ | ④ | ⑤ | ① |
| 收集的O2占容积的体积分数(%) | 10 | 20 | 30 | 40 | 50 | 31 | 33 | 35 | 37 | 39 | 34 |
| 带火星木条的状况 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 | 很亮 | 很亮 | 复燃 | 复燃 | 复燃 | 很亮 |
①本实验中使用带火星的木条验满氧气的方法是否可靠: (填“是”或“否”)。
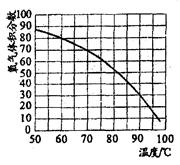
②收集的氧气占容积的体积分数最低为 %时,可使带火星的木条复燃,这时集气瓶中氧气的体积分数是 %(计算结果保留整数)。
③用带火星的木条直接检验双氧水受热分解产生的氧气时,往往难以复燃,这是因为在加热生成氧气的同时产生大量水蒸气所致,此时混合气体中氧气的体积分数随温度变化的曲线如右图所示。若只考虑氧气的体积分数对实验结果的影响,欲使带火星的木条复燃,应将加热双氧水的最高温度控制在 ℃。
小亮用图1装置在做“盐酸中和氢氧化钠溶液”的实验时,
滴加盐酸前忘了加入指示剂,导致无法判断该中和反应是否恰好反应完全.于是他对所得溶液的酸碱性进行了探究.

[探究目的]探究所得溶液的酸碱性
[提出猜想]所得溶液可能呈碱性,也可能呈酸性,还可能呈中性.
[实验验证]
| 实验操作 | 实验现象 | 结论 |
| 用试管取该溶液1-2mL,滴入1-2滴无色酚酞试液,振荡 | 无色酚酞试液变 | 溶液呈碱性 |
| 无色酚酞试液不变色 | 溶液可能呈中性或酸性 |
(1)若溶液呈碱性,则溶液中使其呈碱性的离子是________(填写粒子符号);
(2)若无色酚酞试液不变色,为了进一步确定溶液的酸碱性,小亮提出了以下方案:
方案一:取样,加入碳酸钠溶液,若观察到________,则所取溶液呈酸性;若无明显现象,则呈中性.
方案二:取样,加入金属锌,若有气泡产生,则所取溶液呈酸性,该反应的化学方程式为________;若无明显现象,则呈中性.
[反思与评价]
(1)小建认为若要判断“盐酸和氢氧化钠溶液是否反应”时,只需要选择(图2)的方法即可,请你分析小建选择(图2)的方法的原因是:________.
(2)小娜查阅了相关资料得知,盐酸与氢氧化钠反应的微观示意图可以用(图3)来表示,试从微观粒子的变化角度分析中和反应的实质是________.
小亮用图1装置在做“盐酸中和氢氧化钠溶液”的实验时,
滴加盐酸前忘了加入指示剂,导致无法判断该中和反应是否恰好反应完全.于是他对所得溶液的酸碱性进行了探究.
[探究目的]探究所得溶液的酸碱性
[提出猜想]所得溶液可能呈碱性,也可能呈酸性,还可能呈中性.
[实验验证]
[分析与思考]
(1)若溶液呈碱性,则溶液中使其呈碱性的离子是______(填写粒子符号);
(2)若无色酚酞试液不变色,为了进一步确定溶液的酸碱性,小亮提出了以下方案:
方案一:取样,加入碳酸钠溶液,若观察到______,则所取溶液呈酸性;若无明显现象,则呈中性.
方案二:取样,加入金属锌,若有气泡产生,则所取溶液呈酸性,该反应的化学方程式为______;若无明显现象,则呈中性.
[反思与评价]
(1)小建认为若要判断“盐酸和氢氧化钠溶液是否反应”时,只需要选择(图2)的方法即可,请你分析小建选择(图2)的方法的原因是:______.
(2)小娜查阅了相关资料得知,盐酸与氢氧化钠反应的微观示意图可以用(图3)来表示,试从微观粒子的变化角度分析中和反应的实质是______.
滴加盐酸前忘了加入指示剂,导致无法判断该中和反应是否恰好反应完全.于是他对所得溶液的酸碱性进行了探究.

[探究目的]探究所得溶液的酸碱性
[提出猜想]所得溶液可能呈碱性,也可能呈酸性,还可能呈中性.
[实验验证]
| 实验操作 | 实验现象 | 结论 |
| 用试管取该溶液1-2mL,滴入1-2滴无色酚酞试液,振荡 | 无色酚酞试液变 | 溶液呈碱性 |
| 无色酚酞试液不变色 | 溶液可能呈中性或酸性 |
(1)若溶液呈碱性,则溶液中使其呈碱性的离子是______(填写粒子符号);
(2)若无色酚酞试液不变色,为了进一步确定溶液的酸碱性,小亮提出了以下方案:
方案一:取样,加入碳酸钠溶液,若观察到______,则所取溶液呈酸性;若无明显现象,则呈中性.
方案二:取样,加入金属锌,若有气泡产生,则所取溶液呈酸性,该反应的化学方程式为______;若无明显现象,则呈中性.
[反思与评价]
(1)小建认为若要判断“盐酸和氢氧化钠溶液是否反应”时,只需要选择(图2)的方法即可,请你分析小建选择(图2)的方法的原因是:______.

(2)小娜查阅了相关资料得知,盐酸与氢氧化钠反应的微观示意图可以用(图3)来表示,试从微观粒子的变化角度分析中和反应的实质是______.

