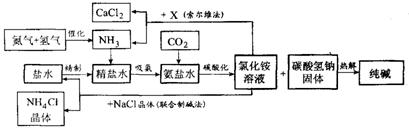
题目内容
将氯化镁和氯化钠的固体混合物25g,加入密度为1.2g/cm3、溶质的质量分数为20%的氢氧化钠溶液50mL,充分反应后,过滤;所得滤液显碱性,在此碱性滤液中加入73g溶质的质量分数为5%的盐酸,恰好完全反应.求恰好完全反应时,滤液的溶质质量分数.
【答案】分析:欲知溶液中的溶质质量分数,须知溶质和溶液的质量.还需明确每次反应后剩余物质是什么,由此计算出溶质质量,再根据溶质质量分数公式进行计算即可.
解答:解:50mL氢氧化钠溶液中NaOH的质量为:50mL×1.2g/cm3×20%=12g;盐酸中HCl的质量为:73g×5%=3.65g(1分)
设与盐酸反应的NaOH的质量为x,生成的氯化钠质量为m1;与NaOH反应的氯化镁的质量为y,生成的氢氧化镁沉淀质量为z,生成的氯化钠质量为m2.
NaOH+HCl═NaCl+H2O
40 36.5 58.5
x 3.65g m1
40:x=36.5:3.65g
解之得x=4g(1分)
58.5:m1=36.5:3.65g
解之得 m1=5.85g
与氯化镁反应的NaOH的质量为:12g-4g=8g
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
95 80 58 117
y 8g z m2
95:y=80:8g
解得y=9.5g
58:z=80:8g
解得z=5.8g
117:m2=80:8g
解得 m2=11.7g
则原混合物中氯化钠的质量为25g-9.5g=15.5g
最后得到的溶液中的氯化钠的质量为15.5g+5.85g+11.7g=33.05g
滤液的溶质质量分数为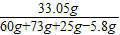 ×100%≈21.7%
×100%≈21.7%
答:恰好完全反应时,滤液的溶质质量分数为:21.7%.
点评:本题主要考查学生运用化学方程式和质量分数公式进行计算的能力.学生必须认真分析题意,找出恰好完全反应时滤液中的溶质有哪些物质,才能正确答题.
解答:解:50mL氢氧化钠溶液中NaOH的质量为:50mL×1.2g/cm3×20%=12g;盐酸中HCl的质量为:73g×5%=3.65g(1分)
设与盐酸反应的NaOH的质量为x,生成的氯化钠质量为m1;与NaOH反应的氯化镁的质量为y,生成的氢氧化镁沉淀质量为z,生成的氯化钠质量为m2.
NaOH+HCl═NaCl+H2O
40 36.5 58.5
x 3.65g m1
40:x=36.5:3.65g
解之得x=4g(1分)
58.5:m1=36.5:3.65g
解之得 m1=5.85g
与氯化镁反应的NaOH的质量为:12g-4g=8g
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
95 80 58 117
y 8g z m2
95:y=80:8g
解得y=9.5g
58:z=80:8g
解得z=5.8g
117:m2=80:8g
解得 m2=11.7g
则原混合物中氯化钠的质量为25g-9.5g=15.5g
最后得到的溶液中的氯化钠的质量为15.5g+5.85g+11.7g=33.05g
滤液的溶质质量分数为
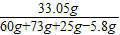 ×100%≈21.7%
×100%≈21.7%答:恰好完全反应时,滤液的溶质质量分数为:21.7%.
点评:本题主要考查学生运用化学方程式和质量分数公式进行计算的能力.学生必须认真分析题意,找出恰好完全反应时滤液中的溶质有哪些物质,才能正确答题.

练习册系列答案
相关题目
 == NH3↑+HCl↑
== NH3↑+HCl↑