题目内容
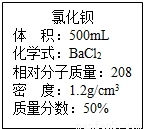
实验室有一瓶浓氯化钡溶液,瓶上标签内容如图所示,请你根据标签上提供的数据解答下列问题.我市某中学课外活动小组在测定RCl和R2S04形成混合物的百分组成时(R代表某金属元素).进行了以下实验.(1)用50ml该浓溶液可以配制溶质质量分数为10%的氯化钡溶液______g.
(2)利用刚配制好的氯化钡溶液测定RCl和R2S04混合物的百分组成:取5g混合物溶解在20g水中,再加入刚配好的溶液20.8g混合至恰好完全反应后过滤,得到一定质量的固体.
①题中发生反应的化学方程式为______.
②利用已知条件求解理论上生成固体(x)的比例式为______.
③已知R原子核外有三个电子层,则R的元素符号是______.
④原混合物中RCl的质量分数为______.
⑤向反应后所得溶液中加入51.53g水,则此时溶液中溶质的质量分数是______.
【答案】分析:先算出50ml该浓溶液中溶质的质量,再根据溶质的质量分数的表达式求出配制溶质质量分数为10%的氯化钡溶液的质量.根据反应物,生成物及反应条件正确写出方程式,由方程式就可以找出关系式.根据元素的化合价及其存在位置可以判断R为钠元素,由方程式求出R2SO4,和生成的NaCl的质量进一步求出RCl的质量分数和反应后所得溶液中加入51.53g水后溶液中溶质的质量分数.
解答:解:(1)用50ml该浓溶液可以配制溶质质量分数为10%的氯化钡溶液的质量为:50ml×1.2g/ml×50%÷10%=300g
(2)①根据反应物,生成物和反应条件及复分解反应的特征可以正确写出方程式:R2SO4+BaCl2=BaSO4↓+2RCl
②设生成BaSO4的质量为 x
R2SO4+BaCl2 =BaSO4↓+2RCl
208 233
20.8×10% x
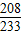 =
=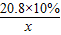 x=2.33g
x=2.33g
③由RCl和R2S04的化学式可知,R元素化合价为+1,且R原子核外有三个电子层,则R元素为钠元素,元素符号是Na
④RCl和R2S04的化学式为NaCl和Na2SO4.设原混合物中Na2SO4的质量为y
Na2SO4+BaCl2 =BaSO4↓+2NaCl
142 233
y 2.33g
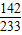 =
=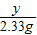
y=1.42g
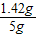 ×100%=28.4%
×100%=28.4%
1-28.4%=71.6%
⑤设反应生成的NaCl的质量为z
Na2SO4+BaCl2 =BaSO4↓+2NaCl
233 117
2.33g z
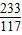 =
=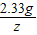
z=1.17g
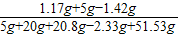 ×100%═5%
×100%═5%
故答案为:
(1)300g
(2)①R2SO4+BaCl2=BaSO4↓+2RCl
②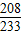 =
=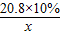
③Na
④71.6%
⑤5%
点评:此题考点较多,在中招试题中并不多见,需仔细分析,认真计算,才会求解.
解答:解:(1)用50ml该浓溶液可以配制溶质质量分数为10%的氯化钡溶液的质量为:50ml×1.2g/ml×50%÷10%=300g
(2)①根据反应物,生成物和反应条件及复分解反应的特征可以正确写出方程式:R2SO4+BaCl2=BaSO4↓+2RCl
②设生成BaSO4的质量为 x
R2SO4+BaCl2 =BaSO4↓+2RCl
208 233
20.8×10% x
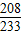 =
=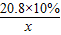 x=2.33g
x=2.33g③由RCl和R2S04的化学式可知,R元素化合价为+1,且R原子核外有三个电子层,则R元素为钠元素,元素符号是Na
④RCl和R2S04的化学式为NaCl和Na2SO4.设原混合物中Na2SO4的质量为y
Na2SO4+BaCl2 =BaSO4↓+2NaCl
142 233
y 2.33g
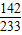 =
=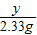
y=1.42g
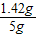 ×100%=28.4%
×100%=28.4%1-28.4%=71.6%
⑤设反应生成的NaCl的质量为z
Na2SO4+BaCl2 =BaSO4↓+2NaCl
233 117
2.33g z
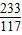 =
=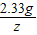
z=1.17g
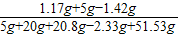 ×100%═5%
×100%═5%故答案为:
(1)300g
(2)①R2SO4+BaCl2=BaSO4↓+2RCl
②
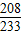 =
=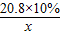
③Na
④71.6%
⑤5%
点评:此题考点较多,在中招试题中并不多见,需仔细分析,认真计算,才会求解.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
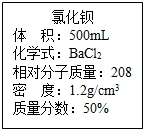 实验室有一瓶浓氯化钡溶液,瓶上标签内容如图所示,请你根据标签上提供的数据解答下列问题.我市某中学课外活动小组在测定RCl和R2S04形成混合物的百分组成时(R代表某金属元素).进行了以下实验.
实验室有一瓶浓氯化钡溶液,瓶上标签内容如图所示,请你根据标签上提供的数据解答下列问题.我市某中学课外活动小组在测定RCl和R2S04形成混合物的百分组成时(R代表某金属元素).进行了以下实验.