题目内容
【题目】金属在生活和生产中有广泛的应用.
(1)下列金属制品中,利用金属导热性的是(填字母序号). 
(2)铁制品在沙漠地区不易锈蚀的原因是 .
(3)收藏家收藏清朝末年的铝制品至今仍保存完好,原因是在常温下,其表面形成了一层致密的氧化铝薄膜:(用化学方程式表示) .
(4)工业上用一氧化碳和赤铁矿反应的化学方程式为 .
(5)金属钯是吸有的贵金属之一,如图2所示,将银、铂戒指分别放入甲、乙两烧杯中,一段时间后取出,发现只有银戒指表面有明显变化,通过该实验判断,银、铂、钯的金属活动性由强到弱的顺序为 . 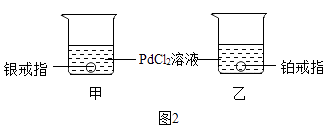
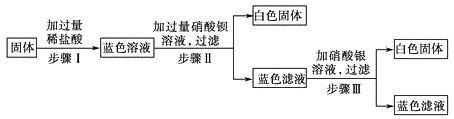
(6)工业上生产电路板及处理废液的工艺流程如下: 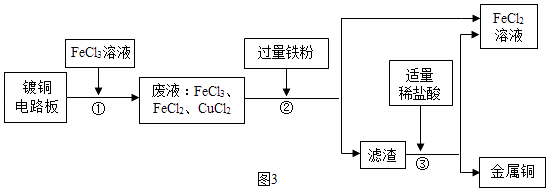
Ⅰ.步骤①反应的化学方程式为 .
Ⅱ.步骤②得到滤渣的成分是 .
【答案】
(1)B
(2)沙漠地区空气中的水蒸气含量极少
(3)4Al+3O2═2Al2O3
(4)Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
(5)银、钯、铂
(6)Cu+2FeCl3=2FeCl2+CuCl2;铁、铜
【解析】解:(1)下列金属制品中,利用金属导热性的是铝用作铝蒸锅,A中利用的是金的延展性,C中利用的是铜的导电性. 故填:B.(2)铁制品在沙漠地区不易锈蚀的原因是沙漠地区空气中的水蒸气含量极少.
故填:沙漠地区空气中的水蒸气含量极少.(3)收藏家收藏清朝末年的铝制品至今仍保存完好,原因是在常温下,其表面形成了一层致密的氧化铝薄膜,反应的化学方程式为:4Al+3O2═2Al2O3 .
故填:4Al+3O2═2Al2O3 . (4)工业上用一氧化碳和赤铁矿反应时,一氧化碳和氧化铁反应生成铁和二氧化碳,反应的化学方程式为:Fe2O3+3CO ![]() 2Fe+3CO2 .
2Fe+3CO2 .
故填:Fe2O3+3CO ![]() 2Fe+3CO2 . (5)一段时间后取出,发现只有银戒指表面有明显变化,说明银和氯化钯发生了化学反应,进一步说明银比钯活泼,而铂表面无明显现象,说明铂不如钯活泼,通过该实验判断,银、铂、钯的金属活动性由强到弱的顺序为银、钯、铂.
2Fe+3CO2 . (5)一段时间后取出,发现只有银戒指表面有明显变化,说明银和氯化钯发生了化学反应,进一步说明银比钯活泼,而铂表面无明显现象,说明铂不如钯活泼,通过该实验判断,银、铂、钯的金属活动性由强到弱的顺序为银、钯、铂.
故填:银、钯、铂.(6)Ⅰ.步骤①中,铜和氯化铁反应生成氯化亚铁和氯化铜,反应的化学方程式为:Cu+2FeCl3=2FeCl2+CuCl2 .
故填:Cu+2FeCl3=2FeCl2+CuCl2 .
Ⅱ.步骤②得到滤渣的成分是反应生成的铜和过量的铁.
故填:铁、铜.
【考点精析】解答此题的关键在于理解金属的物理性质及用途的相关知识,掌握金属的物理性质: (1)常温下一般为固态(汞为液态),有金属光泽.(2)大多数呈银白色(铜为紫红色,金为黄色)(3)有良好的导热性、导电性、延展性,以及对金属材料的选择依据的理解,了解黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属.

【题目】为确定某大理石样品的纯度,某兴趣小组进行如下实验:称取该大理石(杂质不参加反应)加入烧杯中,向其中逐渐加入稀盐酸至完全反应,反应结束后,称量烧杯及其中物质的总质量(溶解的气体忽略不计),有关数据记录如表.
烧杯 | 大理石 | 稀盐酸 | 反应后烧杯及其中物质总质量 | |
质量(g) | 90 | 8.5 | 50 | 145.2 |
(1)实验中判断碳酸钙完全反应的方法是 , 大理石是重要的建筑材料,在实际应用中应避免与接触.
(2)实验中产生的二氧化碳质量为 .
(3)求该大理石的纯度(写出计算过程,计算结果精确到0.1%)