题目内容
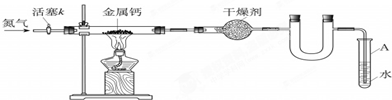
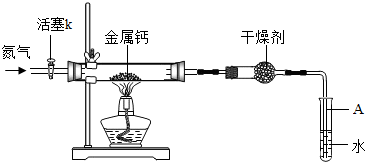
初三兴趣小组利用如下装置(部分固定装置已略去)制备氮化钙,并探究其化学式(实验式).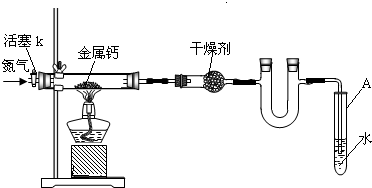
(1)按图连接好实验装置.检查装置气密性的方法是
(2)反应过程中末端导管必须插入试管A的水中,目的是
(3)制备氮化钙的操作步骤是:①打开活塞k并通入N2;②点燃酒精灯,进行反应;③反应结束后,
(4)数据记录如下:
| 空硬玻璃管质量m0/g | 硬玻璃管与钙的质量m1/g | 硬玻璃管与产物的质量m2/g |
| 114.8g | 120.8g | 122.2 |
②若通入的N2中混有少量O2,如上计算得到的x
分析:(1)利用装置内空气受热时膨胀,若在插入水中的导管末端观察到气泡冒出,且在停止受热后又出现导管内形成一段水柱的现象,可检测装置的气密性;
(2)反应产生的尾气氮气不能与水反应也不能溶于水,把导管插入水中可以防止空气从导管进入装置而造成氧气与钙发生反应;
(3)为防止钙与空气中氧气等发生反应,制备氮化钙时应先通入氮气排出装置内空气,然后点燃酒精灯加热进行反应;待反应结束后,为防止水倒流,在将导管从试管内水中撤出前应继续通入氮气,撤出导管后再熄灭酒精灯;最后拆除装置,取出产物;
(4)由实验数据表中数据m1、m2与m0的差,计算参加反应钙的质量及生成氮化钙的质量,根据反应的化学方程式,由两物质的质量计算氮化钙化学式中x值.
(2)反应产生的尾气氮气不能与水反应也不能溶于水,把导管插入水中可以防止空气从导管进入装置而造成氧气与钙发生反应;
(3)为防止钙与空气中氧气等发生反应,制备氮化钙时应先通入氮气排出装置内空气,然后点燃酒精灯加热进行反应;待反应结束后,为防止水倒流,在将导管从试管内水中撤出前应继续通入氮气,撤出导管后再熄灭酒精灯;最后拆除装置,取出产物;
(4)由实验数据表中数据m1、m2与m0的差,计算参加反应钙的质量及生成氮化钙的质量,根据反应的化学方程式,由两物质的质量计算氮化钙化学式中x值.
解答:解:(1)将活塞k关闭,将末端导管插入试管A的水中,用酒精灯微热硬玻璃管,管内空气受热膨胀,若在导管末端观察到有气泡冒出,且在撤去酒精灯冷却后,装置内气体体积减小,导管内形成一段水柱时,可判断装置气密性良好;
(2)导管插入水中,可以防止空气从导管进入装置而与钙发生反应,所以,反应过程中末端导管必须插入试管M的水中目的是:液封,防止空气中的氧气通过末端导管进入实验装置;
(3)为防止试管内的水倒流,反应结束后,需要继续通入氮气,将末端导管从试管A中撤出水面,再熄灭酒精灯;
(4)参加反应钙的质量=120.8g-114.8g=6.0g,反应生成氮化钙的质量=122.2g-114.8g=7.4g;
xCa+N2═CaxN2
40x 40x+28
6.0g 7.4g
=
x=3
故答案为:3.
因为钙的总量不变,含有氧化钙的氮化钙总质量增大,钙与氮(不纯)元素的质量比减小,其个数比也变小,所以x值会减小.若通入的N2中混有少量O2,如上计算得到的x<3.
故答案为:(1)关闭活塞k,将末端导管插入试管A的水中,用酒精灯微热硬玻璃管,若导管末端有气泡冒出,撤去酒精灯冷却后,在导管内形成一段水柱,则证明装置的气密性良好;
(2)防止空气中的氧气通过末端导管进入实验装置,生成氧化钙,引入杂质;
(3)继续通入氮气,将末端导管从试管A中撤出水面,再熄灭酒精灯;
(4)①3;
②<;因为钙的总量不变,含有氧化钙的氮化钙总质量增大,钙与氮(不纯)元素的质量比减小,其个数比也变小,所以x值会减小.
(2)导管插入水中,可以防止空气从导管进入装置而与钙发生反应,所以,反应过程中末端导管必须插入试管M的水中目的是:液封,防止空气中的氧气通过末端导管进入实验装置;
(3)为防止试管内的水倒流,反应结束后,需要继续通入氮气,将末端导管从试管A中撤出水面,再熄灭酒精灯;
(4)参加反应钙的质量=120.8g-114.8g=6.0g,反应生成氮化钙的质量=122.2g-114.8g=7.4g;
xCa+N2═CaxN2
40x 40x+28
6.0g 7.4g
| 40x |
| 6.0g |
| 40x+28 |
| 7.4g |
x=3
故答案为:3.
因为钙的总量不变,含有氧化钙的氮化钙总质量增大,钙与氮(不纯)元素的质量比减小,其个数比也变小,所以x值会减小.若通入的N2中混有少量O2,如上计算得到的x<3.
故答案为:(1)关闭活塞k,将末端导管插入试管A的水中,用酒精灯微热硬玻璃管,若导管末端有气泡冒出,撤去酒精灯冷却后,在导管内形成一段水柱,则证明装置的气密性良好;
(2)防止空气中的氧气通过末端导管进入实验装置,生成氧化钙,引入杂质;
(3)继续通入氮气,将末端导管从试管A中撤出水面,再熄灭酒精灯;
(4)①3;
②<;因为钙的总量不变,含有氧化钙的氮化钙总质量增大,钙与氮(不纯)元素的质量比减小,其个数比也变小,所以x值会减小.
点评:根据实验装置图,分析实验各装置的作用,理解兴趣小组同学制备氮化钙的实验方法,是解答本问题的基础.

练习册系列答案
 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
金属钠是非常活泼的金属,常温下易与氧气、氮气、水等反应.用钠和氮气制得的叠氮钠用于医药、农药等的有机合成,还可用于防酶,血清防腐,污水含氮量测定等.江海实验学校初三兴趣小组利用如下装置(部分固定装置已略去),制备叠氮钠,并探究其化学式.
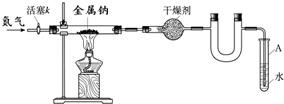
(1)写出钠和氧气反应生成氧化钠的化学方程式 .
(2)按图连接好实验装置.检查装置气密性的方法是 .
(3)干燥装置的作用是 ,末端导管必须始终用试管A中的水液封,目的是 .
(4)制备叠氮钠的操作步骤是:①打开活塞k并通入N2;②点燃酒精灯,进行反应;
③反应结束后, ;④拆除装置,取出产物.
(5)数据记录如下:
①计算得到化学式NaNx,其中x= .
②若通入的N2中混有少量O2,如上测得的m2 140.8g(填写“>”、“=”、“<”).

(1)写出钠和氧气反应生成氧化钠的化学方程式
(2)按图连接好实验装置.检查装置气密性的方法是
(3)干燥装置的作用是
(4)制备叠氮钠的操作步骤是:①打开活塞k并通入N2;②点燃酒精灯,进行反应;
③反应结束后,
(5)数据记录如下:
| 空硬玻璃管质量m0/g | 硬玻璃管与钠的质量m1/g | 硬玻璃管与产物的质量m2/g |
| 114.8 | 124 | 140.8 |
②若通入的N2中混有少量O2,如上测得的m2

 请你初步推断氮化钙的化学式
请你初步推断氮化钙的化学式