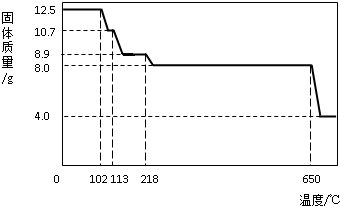
题目内容
5g固体氧化物X,经过以下两步反应后,得到2g红色固体单质C.
上述第②步恰好反应完全,溶液B只含一种溶质,且是盐.
(1)第①步盐酸是否过量 ?判断根据是什么? .
(2)X是 (填写化学式).
【答案】分析:此题的解题突破口在于得到了红色固体单质C,此物质为铜,铁粉与溶液A反应得到了无色气体D,说明①步盐酸过量,固体氧化物X与盐酸反应的生成物能与铁粉反应生成铜,故X为氧化铜.
解答:解:(1)铁粉与溶液A反应得到了无色气体D,说明①步盐酸过量,所以本题答案为:过量,因为加入铁粉时,有无色气体氢气生成;
(2)红色固体单质C为铜,固体氧化物X与盐酸反应的生成物能与铁粉反应生成铜,故X为氧化铜所以本题答案为:CuO.
点评:此题为框图式物质推断题,完成此类题目,关键是找准解题突破口,直接得出结论,然后利用顺向或逆向或两边向中间推,逐一导出其他结论.
解答:解:(1)铁粉与溶液A反应得到了无色气体D,说明①步盐酸过量,所以本题答案为:过量,因为加入铁粉时,有无色气体氢气生成;
(2)红色固体单质C为铜,固体氧化物X与盐酸反应的生成物能与铁粉反应生成铜,故X为氧化铜所以本题答案为:CuO.
点评:此题为框图式物质推断题,完成此类题目,关键是找准解题突破口,直接得出结论,然后利用顺向或逆向或两边向中间推,逐一导出其他结论.

练习册系列答案
相关题目
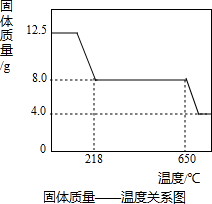 某企业是一家以生产电缆类产品为主的地方明星企业.在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆).某化学兴趣小组的同学得知这一情况后,提出可以用含铜废料制备胆矾(CuSO4?5H2O).
某企业是一家以生产电缆类产品为主的地方明星企业.在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆).某化学兴趣小组的同学得知这一情况后,提出可以用含铜废料制备胆矾(CuSO4?5H2O).


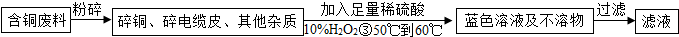
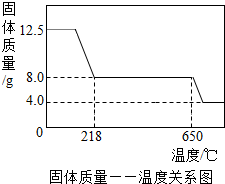
 硫酸铜是生产、生活中常见的物质,下面是某学习小组展开的探究实录:
硫酸铜是生产、生活中常见的物质,下面是某学习小组展开的探究实录: