题目内容
(2011?青岛二模)在一烧杯中盛有100gCuSO4和H2SO4的混合溶液,向其中逐渐滴加溶质的质量分数为10%的NaOH溶液,混合溶液的质量与所滴入NaOH溶液的质量关系曲线如下图所示:
请根据题意回答下列问题:
(1)在实验过程中产生沉淀的总质量是______.
(2)在实验过程中加入60gNaOH溶液时所得溶液的pH是______7(填“大于”、“小于”或“等于”之一).
(3)在实验过程中加入60gNaOH溶液时,通过计算求此时所得不饱和溶液中溶质的质量分数.(计算结果精确至0.1%)
【答案】分析:(1)从图中可看出20g氢氧化钠溶液与混合溶液中的硫酸恰好完全反应,40g氢氧化钠溶液与混合溶液中的硫酸铜恰好完全反应.可利用氢氧化钠与硫酸铜反应的化学方程式,根据氢氧化钠的质量求出沉淀氢氧化铜的质量.
(2)根据硫酸铜、硫酸与氢氧化钠是否恰好完全反应来确定溶液的酸碱性.
(3)所得溶液中溶质的质量分数= %,溶质是硫酸钠,包括硫酸与氢氧化钠反应生成的硫酸钠和硫酸铜与氢氧化钠反应生成的硫酸钠;溶液的质量=所加入的所用物质的总质量-生成沉淀的质量.
%,溶质是硫酸钠,包括硫酸与氢氧化钠反应生成的硫酸钠和硫酸铜与氢氧化钠反应生成的硫酸钠;溶液的质量=所加入的所用物质的总质量-生成沉淀的质量.
解答:解:(1)设沉淀的质量为x
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
80 98
40g×10% x
=4g
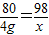
x=4.9g
故答案为:4.9g
(2)根据上图分析可知20克氢氧化钠溶液与混合溶液中硫酸恰好完全反应,40克氢氧化钠溶液与混合溶液中的硫酸铜恰好完全反应,反应后所得溶液为硫酸钠溶液,显中性,pH=7.故答案为:等于
(3)设硫酸和氢氧化钠反应生成硫酸钠的质量为y,硫酸铜和氢氧化钠反应生成硫酸钠的质量为z
H2SO4+2NaOH=Na2SO4+2H2O CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
80 142 98 142
20g×10% y 4.9g z
=2g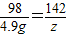
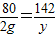 z=7.1g
z=7.1g
y=3.55g
所得硫酸钠溶液中溶质质量分数是: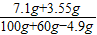 ×100%=6.9%
×100%=6.9%
答:所得溶液中溶质的质量分数为6.9%.
点评:本题的难点是上述图的分析,向硫酸铜和硫酸的混合溶液中加入氢氧化钠溶液,硫酸铜和硫酸都会与氢氧化钠发生反应,但硫酸铜与氢氧化钠反应生成的氢氧化铜沉淀遇到硫酸又会反应生成硫酸铜,所以只要有硫酸存在我们就看不到有沉淀生成,因而我们可以认为氢氧化钠先与硫酸反应,和硫酸反应完后氢氧化钠才与硫酸铜反应.
(2)根据硫酸铜、硫酸与氢氧化钠是否恰好完全反应来确定溶液的酸碱性.
(3)所得溶液中溶质的质量分数=
 %,溶质是硫酸钠,包括硫酸与氢氧化钠反应生成的硫酸钠和硫酸铜与氢氧化钠反应生成的硫酸钠;溶液的质量=所加入的所用物质的总质量-生成沉淀的质量.
%,溶质是硫酸钠,包括硫酸与氢氧化钠反应生成的硫酸钠和硫酸铜与氢氧化钠反应生成的硫酸钠;溶液的质量=所加入的所用物质的总质量-生成沉淀的质量.解答:解:(1)设沉淀的质量为x
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
80 98
40g×10% x
=4g
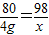
x=4.9g
故答案为:4.9g
(2)根据上图分析可知20克氢氧化钠溶液与混合溶液中硫酸恰好完全反应,40克氢氧化钠溶液与混合溶液中的硫酸铜恰好完全反应,反应后所得溶液为硫酸钠溶液,显中性,pH=7.故答案为:等于
(3)设硫酸和氢氧化钠反应生成硫酸钠的质量为y,硫酸铜和氢氧化钠反应生成硫酸钠的质量为z
H2SO4+2NaOH=Na2SO4+2H2O CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
80 142 98 142
20g×10% y 4.9g z
=2g
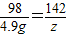
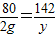 z=7.1g
z=7.1gy=3.55g
所得硫酸钠溶液中溶质质量分数是:
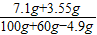 ×100%=6.9%
×100%=6.9%答:所得溶液中溶质的质量分数为6.9%.
点评:本题的难点是上述图的分析,向硫酸铜和硫酸的混合溶液中加入氢氧化钠溶液,硫酸铜和硫酸都会与氢氧化钠发生反应,但硫酸铜与氢氧化钠反应生成的氢氧化铜沉淀遇到硫酸又会反应生成硫酸铜,所以只要有硫酸存在我们就看不到有沉淀生成,因而我们可以认为氢氧化钠先与硫酸反应,和硫酸反应完后氢氧化钠才与硫酸铜反应.

练习册系列答案
相关题目
(2011?青岛二模)做中和反应实验时,我将稀盐酸滴入氢氧化钠溶液中,意外看到有气泡产生.小伟提醒:是不是拿错了药品?我查验后确认药品没错,只是在瓶口发现有白色粉末状物质.我认为是氢氧化钠溶液变质了.
(1)氢氧化钠溶液变质的原因是______.
(2)利用与上述实验不同的原理,我又设计了一个实验再次确认该氢氧化钠溶液已变质.
(3)该氢氧化钠溶液是部分变质还是全部变质?
写出(3)中所涉及到的一个化学方程式______.
(4)如何用该变质的溶液来制取氢氧化钠溶液?简述实验步骤.
(1)氢氧化钠溶液变质的原因是______.
(2)利用与上述实验不同的原理,我又设计了一个实验再次确认该氢氧化钠溶液已变质.
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量氧氧化钠溶液于试管中,滴加_____________ | 该氢氧化钠溶液已变质 |
| 实验步骤 | 实验现象 | 实验结论 |
| 1、取少量样品于试管中, 2、加入足量的______溶液, 3、过滤, 4、在滤液中滴加______溶液 | 2、产生白色沉淀 4、______ | 氢氧化钠______ (部分或全部)变质 |
(4)如何用该变质的溶液来制取氢氧化钠溶液?简述实验步骤.
 ,对该元素的有关认识正确的是( )
,对该元素的有关认识正确的是( )