题目内容
25.(2009?潍坊)某化学小组的同学到钢铁厂做社会调查.他们抽取组成完全相同的质量为2.84g、4.26g、6.23g的三份铁合金样品(假设样中只含铁和碳),在三份样品中分别加入94.6g稀硫酸中进行实验(实验编号I、Ⅱ、Ⅲ),充分反应后,将得到的实验数据绘制出如图象试回答:(已知生铁含碳2%~4.3%,钢含碳0.03%~2%)
(1)实验I中参加反应的铁质量为______克,该合金是______(生铁或钢).
(2)实验Ⅱ中参加反应的硫酸质量是______克.
(3)实验______中稀硫酸完全参加反应,反应后溶液中溶质的质量分数是多少?

【答案】分析:(1)由实验数据图象,完全反应放出氢气质量为0.10g,根据氢气质量计算参加反应铁的质量,通过计算含碳量判断样品的种类;
(2)根据反应放出氢气质量0.15g,计算参加反应的硫酸的质量;
(3)对比钢铁样品质量与放出氢气质量的关系,判断稀硫酸参加反应的情况;并计算稀硫酸完全反应时,生成硫酸亚铁的质量,计算出生成硫酸亚铁与所得溶液的质量比.
解答:解:(1)设参加反应的铁质量为x
Fe+H2SO4=H2↑+FeSO4
56 2
x 0.10g
56:2=x:0.10g 解之得 x=2.8g
2.84g钢铁样品中含C量= ×100%≈1.4%<2%
×100%≈1.4%<2%
故答案为:2.8(1分);钢(1分);
(2)设参加反应的硫酸质量为y
Fe+H2SO4=H2↑+FeSO4
98 2
y 0.15g
98:2=y:0.15g 解之得 y=7.35g
故答案为:7.35(1分)
(3)2.84g钢铁样品完全反应放出氢气质量为0.10g,
那么,6.23g钢铁样品完全反应放出氢气质量= ×0.10g≈0.22g
×0.10g≈0.22g
而第III次实验中得到氢气质量为0.2g<0.22g,钢铁样品未完全反应,则稀硫酸完全反应;
故答案为:Ⅲ(1分);
设铁和硫酸亚铁的质量分别是x、y
Fe+H2SO4=H2↑+FeSO4
56 2 152
x 0.2g y
 解之得 x=5.6g
解之得 x=5.6g
 解之得 y=15.2g
解之得 y=15.2g
反应后溶液中溶质的质量分数= ×100%=15.2%
×100%=15.2%
答:反应后溶液中溶质的质量分数为15.2%.
点评:根据质量守恒定律,反应后溶液中溶质的质量=参加反应铁的质量+参加反应稀硫酸的质量-反应放出氢气的质量.
(2)根据反应放出氢气质量0.15g,计算参加反应的硫酸的质量;
(3)对比钢铁样品质量与放出氢气质量的关系,判断稀硫酸参加反应的情况;并计算稀硫酸完全反应时,生成硫酸亚铁的质量,计算出生成硫酸亚铁与所得溶液的质量比.
解答:解:(1)设参加反应的铁质量为x
Fe+H2SO4=H2↑+FeSO4
56 2
x 0.10g
56:2=x:0.10g 解之得 x=2.8g
2.84g钢铁样品中含C量=
 ×100%≈1.4%<2%
×100%≈1.4%<2%故答案为:2.8(1分);钢(1分);
(2)设参加反应的硫酸质量为y
Fe+H2SO4=H2↑+FeSO4
98 2
y 0.15g
98:2=y:0.15g 解之得 y=7.35g
故答案为:7.35(1分)
(3)2.84g钢铁样品完全反应放出氢气质量为0.10g,
那么,6.23g钢铁样品完全反应放出氢气质量=
 ×0.10g≈0.22g
×0.10g≈0.22g而第III次实验中得到氢气质量为0.2g<0.22g,钢铁样品未完全反应,则稀硫酸完全反应;
故答案为:Ⅲ(1分);
设铁和硫酸亚铁的质量分别是x、y
Fe+H2SO4=H2↑+FeSO4
56 2 152
x 0.2g y
 解之得 x=5.6g
解之得 x=5.6g 解之得 y=15.2g
解之得 y=15.2g反应后溶液中溶质的质量分数=
 ×100%=15.2%
×100%=15.2%答:反应后溶液中溶质的质量分数为15.2%.
点评:根据质量守恒定律,反应后溶液中溶质的质量=参加反应铁的质量+参加反应稀硫酸的质量-反应放出氢气的质量.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
25.(2009?潍坊)某化学探究小组用HCl与大理石反应研究影响反应剧烈程度的因素.实验温度为25℃、35℃;大理石有细颗粒与粗颗粒两种规格,每次实验取用含碳酸钙60%的大理石10g;所用HCl的质量分数为9.125%、18.25%,每次实验HCl的用量为20mL(假设9.125%、18.25%的盐酸的密度均为1g/em3;大理石中杂质不与盐酸反应).
(1)反应原理:实验中的化学方程式______.
(2)提出假设:HCl与大理石反应的剧烈程度与所用HCl的质量分数、大理石规格、反应温度有关.
(3)实验设计与实施:完成以下实验设计方案并实
(4)实验结论:______.
(5)绘制图象:实验①中CO2质量随时问变化的关系如图,借助简单计算请在右图中画出实验②和③中CO2质量随时间变化关系的曲线(忽略溶液体积变化).
说明:可以用铅笔画曲线.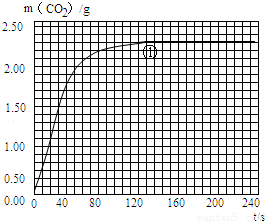
(1)反应原理:实验中的化学方程式______.
(2)提出假设:HCl与大理石反应的剧烈程度与所用HCl的质量分数、大理石规格、反应温度有关.
(3)实验设计与实施:完成以下实验设计方案并实
| 实验编号 | T/℃ | 大理石 规格 | HCl的质量分数 | 完全反应的 时间/s | 实验目的 |
| ① | 25 | 粗颗粒 | 18.25% | 160 | (Ⅰ)实验①和②探究同体积下HCl的质量分数对该反应剧烈程度的影响. (Ⅱ)实验①和③探究温度对该反应剧烈程度的影响. (Ⅲ)实验①和④探究大理石规格对该反应剧烈程度的影响. |
| ② | ______ | ______ | ______ | 210 | |
| ③ | 35 | 粗颗粒 | 18.25% | 60 | |
| ④ | ______ | ______ | ______ | 100 |
(5)绘制图象:实验①中CO2质量随时问变化的关系如图,借助简单计算请在右图中画出实验②和③中CO2质量随时间变化关系的曲线(忽略溶液体积变化).
说明:可以用铅笔画曲线.


