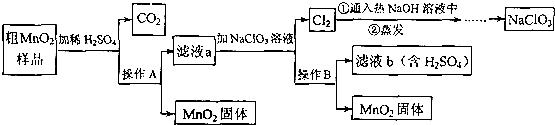
题目内容
 某研究性学习小组在协助老师清理实验储备室时,发现一批存放多年的氢氧化钙.为检验其变质情况,进行了如下探究:取氢氧化钙样品11.4g于锥形瓶中,加入38.6g水,振荡形成悬浊液,放在电子天平上,向锥形瓶中逐滴滴加14.6%的稀盐酸,振荡后读取质量(如图甲所示).实验测得加入稀盐酸的质量与锥形瓶中物质的质量关系如图乙所示.求:
某研究性学习小组在协助老师清理实验储备室时,发现一批存放多年的氢氧化钙.为检验其变质情况,进行了如下探究:取氢氧化钙样品11.4g于锥形瓶中,加入38.6g水,振荡形成悬浊液,放在电子天平上,向锥形瓶中逐滴滴加14.6%的稀盐酸,振荡后读取质量(如图甲所示).实验测得加入稀盐酸的质量与锥形瓶中物质的质量关系如图乙所示.求:
(1)由图乙可知,与Ca(OH)2反应的稀盐酸的质量为______g.
(2)11.4g该样品中各成分的质量.
解:(1)加入的盐酸先与氢氧化钙反应,所以由图示可知与Ca(OH)2反应的稀盐酸的质量为50g;
(2)由题意和图象分析知,第一阶段锥形瓶中物质增加的质量就是与样品中氢氧化钙反应的盐酸的质量,第一阶段滴入盐酸的质量为100g-50g=50g
设与盐酸反应的Ca(OH)2的质量为x
Ca(OH)2+2HCl=CaCl2+2H2O
74 73
x 50g×14.6%
根据: 解得x=7.4g
解得x=7.4g
混合物中碳酸钙的质量为11.4g-7.4g=4g
答:此样品中氢氧化钙的质量是7.4g,碳酸钙的质量是4g.
分析:氢氧化钙吸收空气中的二氧化碳生成碳酸钙而变质;向变质的氢氧化钙的浊液中滴加盐酸,盐酸先与氢氧化钙反应,生成氯化钙和水,而不能产生气体,因此,随盐酸的滴加瓶内质量不断增加,如图乙中的第一段曲线所示;当氢氧化钙完全反应后,继续滴加的盐酸开始与碳酸钙反应,即从图乙瓶内质量为100g时始,碳酸钙与盐酸反应生成氯化钙和水,同时放出气体二氧化碳,因此随盐酸的滴加瓶内物质质量增加情况如图乙中的第二段曲线;至碳酸钙完全反应后,滴加的盐酸不发生反应,瓶内质量增加情况如图乙中第三段曲线;根据与氢氧化钙阶段反应的化学方程式及消耗盐酸的质量,可计算出参加反应的氢氧化钙的质量,碳酸钙的质量为样品与氢氧化钙的质量差.
点评:根据物质间反应的先后关系,分析反应对容器内物质质量的影响,得出所加入溶液的质量;然后根据反应的化学方程式,完成分析与计算.
(2)由题意和图象分析知,第一阶段锥形瓶中物质增加的质量就是与样品中氢氧化钙反应的盐酸的质量,第一阶段滴入盐酸的质量为100g-50g=50g
设与盐酸反应的Ca(OH)2的质量为x
Ca(OH)2+2HCl=CaCl2+2H2O
74 73
x 50g×14.6%
根据:
 解得x=7.4g
解得x=7.4g混合物中碳酸钙的质量为11.4g-7.4g=4g
答:此样品中氢氧化钙的质量是7.4g,碳酸钙的质量是4g.
分析:氢氧化钙吸收空气中的二氧化碳生成碳酸钙而变质;向变质的氢氧化钙的浊液中滴加盐酸,盐酸先与氢氧化钙反应,生成氯化钙和水,而不能产生气体,因此,随盐酸的滴加瓶内质量不断增加,如图乙中的第一段曲线所示;当氢氧化钙完全反应后,继续滴加的盐酸开始与碳酸钙反应,即从图乙瓶内质量为100g时始,碳酸钙与盐酸反应生成氯化钙和水,同时放出气体二氧化碳,因此随盐酸的滴加瓶内物质质量增加情况如图乙中的第二段曲线;至碳酸钙完全反应后,滴加的盐酸不发生反应,瓶内质量增加情况如图乙中第三段曲线;根据与氢氧化钙阶段反应的化学方程式及消耗盐酸的质量,可计算出参加反应的氢氧化钙的质量,碳酸钙的质量为样品与氢氧化钙的质量差.
点评:根据物质间反应的先后关系,分析反应对容器内物质质量的影响,得出所加入溶液的质量;然后根据反应的化学方程式,完成分析与计算.

练习册系列答案
相关题目
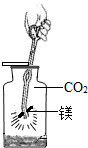 某研究性学习小组在一本参考书上发现,镁居然能在二氧化碳气体中燃烧!于是他们进行了这个实验:将镁条点燃后迅速伸人盛有二氧化碳的集气瓶中,发现镁条剧烈燃烧.发出白光,放热,产生一种白色粉末和一
某研究性学习小组在一本参考书上发现,镁居然能在二氧化碳气体中燃烧!于是他们进行了这个实验:将镁条点燃后迅速伸人盛有二氧化碳的集气瓶中,发现镁条剧烈燃烧.发出白光,放热,产生一种白色粉末和一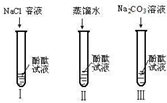 19、某研究性学习小组在实验中发现:不仅碱溶液可以使酚酞试液变红,Na2CO3溶液也能使酚酞试液变红.碱溶液可以使酚酞试液变红,是因为碱在水中解离出了OH-,那么Na2CO3溶液中究竟是哪种粒子可以使酚酞试液变红呢?他们设计了如图三个实验,请你和他们一起探究并完成下列问题:
19、某研究性学习小组在实验中发现:不仅碱溶液可以使酚酞试液变红,Na2CO3溶液也能使酚酞试液变红.碱溶液可以使酚酞试液变红,是因为碱在水中解离出了OH-,那么Na2CO3溶液中究竟是哪种粒子可以使酚酞试液变红呢?他们设计了如图三个实验,请你和他们一起探究并完成下列问题: